名校
1 . 下列实验能达到预期目的是
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测定浓度为0.1mol·L−1NaClO溶液和0.1mol·L−1 溶液的pH 溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 等体积pH=2的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX放出的氢气多且反应速率快 | 证明HX酸性比HY强 |
| C | 取1mL0.1mol∙L-1KI溶液于试管中,加入5mL0.1mol∙L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液,溶液显红色 | 证明KI与FeCl3反应是可逆反应 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-01更新
|
72次组卷
|
2卷引用:新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题
名校
解题方法
2 .  时,用
时,用 溶液分别滳定
溶液分别滳定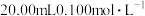 的盐酸和醋酸溶液、滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸溶液、滴定曲线如图所示。下列说法正确的是

 时,用
时,用 溶液分别滳定
溶液分别滳定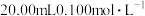 的盐酸和醋酸溶液、滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸溶液、滴定曲线如图所示。下列说法正确的是
A. 时, 时, 电离常数 电离常数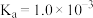 |
B.a点时混合溶液中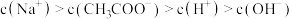 |
| C.d点时,曲线Ⅰ与曲线Ⅱ消耗NaOH的体积为曲线Ⅰ>曲线Ⅱ |
D.a、b、c三点溶液中由水电离出的 大小顺序为 大小顺序为 |
您最近一年使用:0次
2023-07-15更新
|
397次组卷
|
5卷引用:新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题
新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题湖北省荆州中学2023-2024学年高二上学期10月月考化学试题四川省广安市华蓥中学2023-2024学年高二上学期12月月考化学试题贵州省铜仁市2022-2023学年高二下学期7月质量监测化学试题(已下线)题型02 溶液中粒子浓度大小比较-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
名校
解题方法
3 . 下列实验能达到预期目的是
A.向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅,证明 固体,溶液红色变浅,证明 溶液中存在水解平衡 溶液中存在水解平衡 |
B.室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和 溶液的pH,比较HClO和 溶液的pH,比较HClO和 的酸性强弱 的酸性强弱 |
C.等体积 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 |
D.向10mL0.2mol/LNaOH溶液中滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: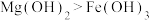 |
您最近一年使用:0次
2023-06-21更新
|
131次组卷
|
16卷引用:新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题
新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题河南省南乐县第一高级中学2021-2022学年高二下学期3月月考化学试题湖南省长沙市南雅中学2022-2023学年高二上学期第三次月考化学试题江苏省徐州市沛县2022-2023学年高二下学期5月月考化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期(强基班)11月月考化学试题安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评广东省梅州市2021-2022学年高二上学期期末考试化学试题江苏省泰州中学2021-2022学年高二下学期期中考试化学试题湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题河南省安阳市第一中学2020-2021学年高二上学期期末考试化学试题江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题
4 . 常温下,肼 的水溶液显碱性,存在如下平衡:
的水溶液显碱性,存在如下平衡: ;
;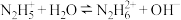 。平衡时溶液中含氮微粒的分布分数
。平衡时溶液中含氮微粒的分布分数 与溶液
与溶液 的关系如图所示。向
的关系如图所示。向 的水溶液中逐滴滴加
的水溶液中逐滴滴加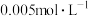 的稀硫酸,下列说法正确的是
的稀硫酸,下列说法正确的是

 的水溶液显碱性,存在如下平衡:
的水溶液显碱性,存在如下平衡: ;
;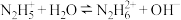 。平衡时溶液中含氮微粒的分布分数
。平衡时溶液中含氮微粒的分布分数 与溶液
与溶液 的关系如图所示。向
的关系如图所示。向 的水溶液中逐滴滴加
的水溶液中逐滴滴加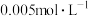 的稀硫酸,下列说法正确的是
的稀硫酸,下列说法正确的是
A. 的电子式: 的电子式: |
B. 的平衡常数为 的平衡常数为 |
C.当加入5.00mL稀硫酸时,溶液中: |
D.当加入10.00mL稀硫酸时,溶液中: |
您最近一年使用:0次
2023-05-07更新
|
1088次组卷
|
4卷引用:新疆石河子第一中学2023-2024学年高三上学期11月月考化学试题
5 . 水溶液中的离子反应与平衡。
(1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是_______ (用字母表示,下同)。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是_______ 。
(2)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0 mol∙L-1,则溶液中OH-的浓度是_______ mol∙L-1。
(3)在200 mL氢氧化钡溶液中含有1×10-3 mol的钡离子,溶液的pH为_______ 。
(4)室温下,使用pH计测定0.1 mol/L NH4Cl溶液的pH(如图),由此可以得到的结论是_______ 。

a.NH3·H2O是弱碱
b.溶液中c(H+)>c(OH-)
c. 水解是吸热反应
水解是吸热反应
d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(5)试用离子方程式解释0.1 mol/L NH4Cl溶液呈酸性的原因_______ 。
(1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是
(2)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0 mol∙L-1,则溶液中OH-的浓度是
(3)在200 mL氢氧化钡溶液中含有1×10-3 mol的钡离子,溶液的pH为
(4)室温下,使用pH计测定0.1 mol/L NH4Cl溶液的pH(如图),由此可以得到的结论是

a.NH3·H2O是弱碱
b.溶液中c(H+)>c(OH-)
c.
 水解是吸热反应
水解是吸热反应d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(5)试用离子方程式解释0.1 mol/L NH4Cl溶液呈酸性的原因
您最近一年使用:0次
名校
6 . 物质的量浓度相同的下列溶液,pH由大到小排列正确的是
| A.NaHCO3、C6H5COOH、C2H5OH、HCl |
| B.Na2CO3、C6H5ONa、NaHCO3、C6H5OH |
| C.NH3▪H2O、H3PO4、Na2SO4、H2SO4 |
| D.Na2CO3、NaHCO3、C6H5ONa、C6H5OH |
您最近一年使用:0次
名校
解题方法
7 . 下列说法正确的是
| A.强电解质溶液的导电能力一定比弱电解质溶液强 |
| B.相同条件下,同浓度的碳酸钠和醋酸钠溶液,醋酸钠溶液的碱性更强 |
| C.如果盐酸的浓度是醋酸的两倍,则盐酸的H+浓度也是醋酸的二倍 |
D.物质的量相同的碳酸钠溶液和碳酸溶液中所含的 不同 不同 |
您最近一年使用:0次
2023-02-02更新
|
437次组卷
|
2卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二上学期第二次月考试化学试卷
名校
8 . 稀氨水中存在电离平衡:NH3·H2O NH
NH + OH-。下列说法正确的是
+ OH-。下列说法正确的是
 NH
NH + OH-。下列说法正确的是
+ OH-。下列说法正确的是| A.加入NaOH固体,平衡逆向移动,c(OH-)增大 |
| B.温度不变时,加浓氨水,电离平衡正向移动,电离平衡常数Kb 增大 |
| C.温度不变时,加水稀释,溶液中所有离子浓度都减小 |
D.通入HCl ,平衡正向移动,溶液中c(NH )和c(OH-)均减小 )和c(OH-)均减小 |
您最近一年使用:0次
2022-09-25更新
|
682次组卷
|
4卷引用:新疆昌吉州行知学校2022-2023学年高二上学期第一次线上月考化学试题
名校
解题方法
9 . 298K时,分别向体积、浓度均为20mL0.1mol·L−1的HX溶液、HY溶液中滴加等浓度的NaOH溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示。(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是


| A.298K时,0.1mol·L−1HX溶液中HX的电离度为0.1%,Ka(HX)≈10-7 |
B.V=10mL时,同时微热溶液(忽略体积变化), 逐渐减小 逐渐减小 |
| C.V=20mL时,HX曲线对应的溶液中c(Na+)=c(X−)>c(H+)=c(OH−) |
| D.滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂 |
您最近一年使用:0次
2022-06-28更新
|
119次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三上学期1月月考化学试题
10 . 按要求完成下列问题。
(1)某温度(t℃)时水的图象如图所示,a点离子积K=_______ ,在该温度下, 的溶液显
的溶液显_______ 性(填“酸”“碱”或“中”);在该温度下,将 的苛性钠溶液V1L与
的苛性钠溶液V1L与 的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
_______ 。

(2)25℃时,向 氨水中加入少量
氨水中加入少量 固体,当固体溶解后,测得溶液pH会
固体,当固体溶解后,测得溶液pH会_______ 。(填“增大”“减小”或“不变”)
(3)25℃时,等浓度的 溶液和
溶液和 溶液等体积混合,
溶液等体积混合, ,则混合溶液中各种离子浓度大小关系为
,则混合溶液中各种离子浓度大小关系为_______ 。
(4)已知:HClO的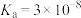 ,
, 的
的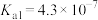 ,
, ,写出往NaClO溶液中通入少量
,写出往NaClO溶液中通入少量 的离子方程式:
的离子方程式:_______ 。
(1)某温度(t℃)时水的图象如图所示,a点离子积K=
 的溶液显
的溶液显 的苛性钠溶液V1L与
的苛性钠溶液V1L与 的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则

(2)25℃时,向
 氨水中加入少量
氨水中加入少量 固体,当固体溶解后,测得溶液pH会
固体,当固体溶解后,测得溶液pH会(3)25℃时,等浓度的
 溶液和
溶液和 溶液等体积混合,
溶液等体积混合, ,则混合溶液中各种离子浓度大小关系为
,则混合溶液中各种离子浓度大小关系为(4)已知:HClO的
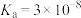 ,
, 的
的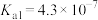 ,
, ,写出往NaClO溶液中通入少量
,写出往NaClO溶液中通入少量 的离子方程式:
的离子方程式:
您最近一年使用:0次
2022-06-23更新
|
104次组卷
|
2卷引用:新疆乌鲁木齐市第101中学2023-2024学年高三上学期8月月考化学试题



