1 . 常温下,向浓度相等的甲酸( )和醋酸(
)和醋酸(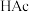 )的混合溶液中滴加氨水,溶液中
)的混合溶液中滴加氨水,溶液中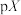 [
[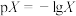 ,
, 、
、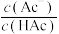 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
 )和醋酸(
)和醋酸(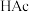 )的混合溶液中滴加氨水,溶液中
)的混合溶液中滴加氨水,溶液中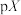 [
[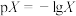 ,
, 、
、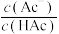 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
A. 代表 代表 与 与 的变化关系 的变化关系 |
B.常温下, |
C.向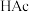 溶液中滴加氨水至Q点: 溶液中滴加氨水至Q点: |
D.上述反应中,最先生成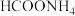 和 和 |
您最近一年使用:0次
2024-06-01更新
|
152次组卷
|
3卷引用:青海省海南州贵德高级中学2023-2024学年高三下学期第九次模拟预测理综试题-高中化学
名校
2 . 常温下,Ka(HCOOH)=1.77 ×10-4, Ka(CH3COOH)=1.75 × 10-5。下列说法正确的是
| A.相同体积pH均为3的HCOOH和CH3COOH溶液,中和NaOH的能力相同 |
| B.0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH等体积混合后:c(HCOO- ) + c(OH -) < c(HCOOH)+ c(H+) |
| C.等浓度的CH3COONa溶液与HCOONa溶液,后者溶液pH大 |
D.将CH3COONa溶液从20°C升温至30°C, 溶液中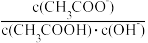 减小 减小 |
您最近一年使用:0次
2022-01-10更新
|
707次组卷
|
3卷引用:青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题
名校
3 . 一般较强酸可制取较弱酸,这是复分解反应的规律之一、已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
(1)①请根据上述信息判断下列反应不能发生的是__ (填编号)。
A.CH3COOH+NaCN=CH3COONa+HCN
B.CO2+H2O+2NaClO=Na2CO3+2HClO
C.2HCN+Na2CO3=2NaCN+CO2↑+H2O
D.Na2CO3+C6H5OH=NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa=NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为__ 。
(2)一些复分解反应的发生还遵循其他规律。下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的另一规律为_ 。
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol•L-1,则该电解质可能是_ (填序号)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(4)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×l0-3mol•L-1的氨水bL;
②c(OH-)=1.0×10-3mol•L-1的氨水cL;
③c(OH-)=1.0×10-3mol•L-1的氢氧化钠溶液dL。
则a、b、c、d之间由大到小的关系是:___ 。
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是___ (填编号)。一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1___ n2(填“>”、“<”或“=”)。
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN=CH3COONa+HCN
B.CO2+H2O+2NaClO=Na2CO3+2HClO
C.2HCN+Na2CO3=2NaCN+CO2↑+H2O
D.Na2CO3+C6H5OH=NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa=NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为
(2)一些复分解反应的发生还遵循其他规律。下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的另一规律为
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol•L-1,则该电解质可能是
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(4)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×l0-3mol•L-1的氨水bL;
②c(OH-)=1.0×10-3mol•L-1的氨水cL;
③c(OH-)=1.0×10-3mol•L-1的氢氧化钠溶液dL。
则a、b、c、d之间由大到小的关系是:
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是
您最近一年使用:0次
名校
解题方法
4 . 常温常压下,将amolCO2气体通入1Lbmol•L-1的NaOH溶液中,下列对所得溶液的描述不正确的是


| A.当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图变化关系 |
B.当a=b时,所得溶液中存在:c(OH-)+c( )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
C.当2a=b时,所得溶液中存在:c(Na+)>c( )>c(OH-)>c( )>c(OH-)>c( )>(H+) )>(H+) |
D.当 < <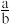 <1时,所得溶液中一定存在:c(Na+)=c( <1时,所得溶液中一定存在:c(Na+)=c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
您最近一年使用:0次
2021-03-18更新
|
98次组卷
|
2卷引用:青海省湟川中学2020-2021学年高二下学期第一次月考化学试题
10-11高二·辽宁·阶段练习
5 . 在25℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最大的是( )
| A.HNO2 | B.HCOOH | C.HCN | D.H2CO3 |
您最近一年使用:0次
2020-11-20更新
|
269次组卷
|
14卷引用:青海省海东市第二中学2018-2019学年高二下学期第二次月考化学试题
青海省海东市第二中学2018-2019学年高二下学期第二次月考化学试题(已下线)2011-2012学年辽宁省东北育才学校高二第一次月考化学试卷2014-2015内蒙古满洲里市七中高二上学期第二次月考化学试卷【全国百强校】黑龙江省哈尔滨市第三中学2018-2019学年高二上学期第二次月考化学试题山东省微山县第二中学2018-2019学年高二上学期第三学段教学质量监测化学试题【全国百强校】内蒙古杭锦后旗奋斗中学2018-2019学年高二下学期第一次月考化学试题四川省广安代市中学校2021-2022学年高二上学期第二次月考化学试题(已下线)2014-2015学年湖南省娄底市高二上学期期中联考化学试卷(已下线)同步君 选修4 第3章 第1节 弱电解质的电离2016-2017学年宁夏育才中学高二上学期期中化学卷高中化学人教版 选修四 第三章 水溶液中的离子反应 第一节 弱电解质的电离 弱电解质的电离鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时1 弱电解质的电离平衡四川省邻水实验学校2020-2021学年高二上学期期中考试化学试题(已下线)3.1.3 电离平衡常数(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
6 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______ 离子通过,氯气的逸出口是_______ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____ mol;产生“气泡”的化学方程式为____________ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2020-07-08更新
|
12800次组卷
|
13卷引用:青海省湟川中学2020-2021学年高二下学期第一次月考化学试题
青海省湟川中学2020-2021学年高二下学期第一次月考化学试题山东省枣庄市第三中学2022届高三第一次月考化学试题2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)2020年全国卷Ⅱ化学真题变式题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用(已下线)专题17 原理综合题
名校
7 . 25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-a mol/L,下列说法不正确的是
| A.a<7时,水的电离受到促进 | B.a>7时,水的电离受到抑制 |
| C.a<7时,溶液的pH一定为a | D.a>7时,溶液的pH一定为14-a |
您最近一年使用:0次
2019-09-29更新
|
2652次组卷
|
16卷引用:2015-2016学年青海师大附属二中高二下4月月考化学试卷
2015-2016学年青海师大附属二中高二下4月月考化学试卷河南省林州市第一中学2019-2020学年高二9月月考化学试题河南林州一中2019-2020学年高二上9月化学测试题山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题重庆市朝阳中学2020-2021学年高二上学期12 月考化学试题海南省北京师范大学万宁附属中学2021-2022学年高二上学期第一次月考化学试题 山西省长治市上党区第一中学校2021-2022学年高二上学期9月月考化学试题 甘肃省张掖市高台县第一中学2022-2023学年高三上学期第四次检测化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时2 盐类的水解原理鲁科版(2019)选择性必修1 模块综合测评高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时1 盐类的水解人教版(2019)高二选择性必修第一册 模块综合测评吉林省公主岭市范家屯镇第一中学2020-2021学年高二上学期期末两校联考化学试题选择性必修1 专题3 第三单元 课时1 盐类水解的原理广东省广州市2022-2023学年高二上学期期末考试化学试题3.3.1盐类水解的原理 课中
名校
8 . 室温下,将碳酸钠溶液加热至70℃,其结果是( )
| A.溶液中c(CO32-)增大 | B.溶液的碱性增强 |
| C.溶液的pH将变小 | D.水的电离程度不变 |
您最近一年使用:0次
名校
9 . 某浓度的氨水中存在下列平衡:NH3·H2O NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
 NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )| A.适当升高温度 | B.加入NaCl固体 | C.加入少量盐酸 | D.通入NH3 |
您最近一年使用:0次
名校
10 . 下列说法不正确的是
| A.稀醋酸中加入少量醋酸钠固体能降低醋酸的电离程度 |
| B.如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍 |
| C.CaCO3的水溶液导电性很弱,但CaCO3是强电解质 |
| D.25 ℃时,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
您最近一年使用:0次



