名校
解题方法
1 . 磷酸锌[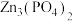 ]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示: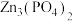 在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
(1)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是___________ (填一条)。
(2)加入H2O2的作用___________
(3)经过滤2得到滤渣的主要成分是 和
和 ,则用NaOH溶液调节pH的范围是
,则用NaOH溶液调节pH的范围是___________ 。
(4)加入Na2HPO4溶液发生反应的离子方程式为___________ 。
(5)洗涤磷酸锌沉淀时应选用___________ (填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是___________ 。
(6)通入H2S是为了除铜离子,25℃时,当通入H2S达到饱和时测得溶液的pH=1,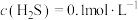 ,此时溶液中
,此时溶液中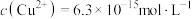 ,则CuS的溶度积
,则CuS的溶度积
___________ (已知:25℃时,H2S的电离平衡常数 ,
, )。
)。
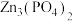 ]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
]常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示: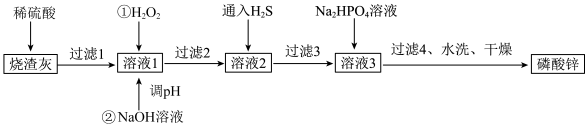
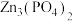 在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
在水中几乎不溶,其在水中的溶解度随温度的升高而降低;②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是
(2)加入H2O2的作用
(3)经过滤2得到滤渣的主要成分是
 和
和 ,则用NaOH溶液调节pH的范围是
,则用NaOH溶液调节pH的范围是(4)加入Na2HPO4溶液发生反应的离子方程式为
(5)洗涤磷酸锌沉淀时应选用
(6)通入H2S是为了除铜离子,25℃时,当通入H2S达到饱和时测得溶液的pH=1,
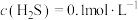 ,此时溶液中
,此时溶液中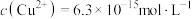 ,则CuS的溶度积
,则CuS的溶度积
 ,
, )。
)。
您最近一年使用:0次
名校
2 . 图(Ⅰ)和图(Ⅱ)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。下列说法正确的是

| A.[H3NCH2CH2NH3]A溶液显碱性 |
B.[H3NCH2CH2NH2]HA溶液中存在关系式: 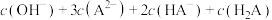 |
C.[H3NCH2CH2NH2][HA]溶液中各离子浓度大小关系为: |
D.向[H3NCH2CH2NH2][HA]溶液中通入一定量的HCl气体,则 可能增大也可能减小 可能增大也可能减小 |
您最近一年使用:0次
名校
解题方法
3 . 一种制备 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数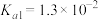 ,
,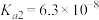 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数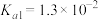 ,
,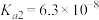 。下列说法正确的是
。下列说法正确的是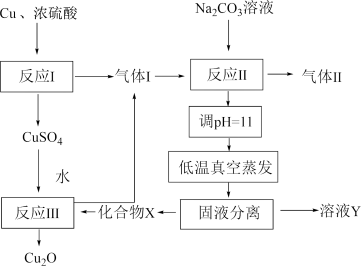
A.反应 、 、 、 、 均为氧化还原反应 均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
C.溶液Y可循环用于反应 所在操作单元吸收气体 所在操作单元吸收气体 |
D.若 产量不变,参与反应 产量不变,参与反应 的X与 的X与 物质的量之比 物质的量之比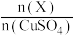 增大时,需补加 增大时,需补加 的量增多 的量增多 |
您最近一年使用:0次
昨日更新
|
66次组卷
|
3卷引用:福建省福州第三中学2023-2024学年高三上学期第五次质量检测化学试题
名校
4 . 室温下6种稀溶液:①HCl、② 、③
、③ 、④
、④ 、⑤氨水、⑥NaOH;回答下列问题:
、⑤氨水、⑥NaOH;回答下列问题:
(1)中和等体积、pH相同的①②③溶液消耗NaOH最多的是______ (用序号填写)
(2)将等体积、等物质的量浓度的③、⑥混合,则溶液的pH______ 7(填“>”、“<”或“=”)。
(3)常温下,aL pH=13的⑥溶液与bLpH=2的②溶液混合所得混合溶液pH=12(混合过程中溶液体积变化忽略不计),则a∶b=______ 。
(4)已知:HClO的 ;
; 的
的 ,
, 。写出向NaClO溶液中通入少量
。写出向NaClO溶液中通入少量 时发生反应的离子方程式:
时发生反应的离子方程式:______ 。
(5)盐碱地(含较多 、NaCl)不利于植物生长,已知
、NaCl)不利于植物生长,已知 的
的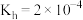 ,当
,当 溶液中
溶液中 时,溶液的
时,溶液的
______ 。
 、③
、③ 、④
、④ 、⑤氨水、⑥NaOH;回答下列问题:
、⑤氨水、⑥NaOH;回答下列问题:(1)中和等体积、pH相同的①②③溶液消耗NaOH最多的是
(2)将等体积、等物质的量浓度的③、⑥混合,则溶液的pH
(3)常温下,aL pH=13的⑥溶液与bLpH=2的②溶液混合所得混合溶液pH=12(混合过程中溶液体积变化忽略不计),则a∶b=
(4)已知:HClO的
 ;
; 的
的 ,
, 。写出向NaClO溶液中通入少量
。写出向NaClO溶液中通入少量 时发生反应的离子方程式:
时发生反应的离子方程式:(5)盐碱地(含较多
 、NaCl)不利于植物生长,已知
、NaCl)不利于植物生长,已知 的
的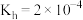 ,当
,当 溶液中
溶液中 时,溶液的
时,溶液的
您最近一年使用:0次
名校
解题方法
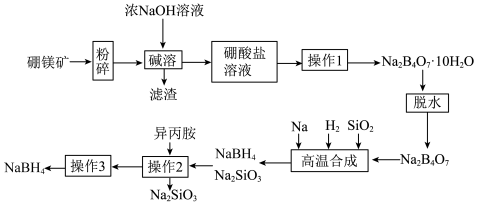
5 . 硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,工业上可用硼镁矿(主要成分为Mg2B2O5∙H2O,含少量杂质Fe3O4)制取NaBH4,其工艺流程如下:
(1)写出一元弱酸硼酸在水中的电离方程式____________ 。NaBH4的电子式为______ 。
(2)碱溶时滤渣的成分是______ (写化学式、下同)。
(3)操作1的步骤包括______ ,操作3的名称是______ 。
(4)高温合成反应的化学方程式为____________ 。
(5)写出副产物硅酸钠的一种用途____________ 。
(6)NaBH4被称为万能还原剂,“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为______ (保留两位小数)。
(1)写出一元弱酸硼酸在水中的电离方程式
(2)碱溶时滤渣的成分是
(3)操作1的步骤包括
(4)高温合成反应的化学方程式为
(5)写出副产物硅酸钠的一种用途
(6)NaBH4被称为万能还原剂,“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为
您最近一年使用:0次
6 . 25℃时,分别向20 mL浓度均1.0 mol∙L-1的HA、NaA溶液中逐滴加入浓度均为1.0 mol∙L-1的NaOH、HCl溶液V mL,溶液的pH与lgY[Y= 或
或 ]的关系如图所示。下列说法不正确的是
]的关系如图所示。下列说法不正确的是
 或
或 ]的关系如图所示。下列说法不正确的是
]的关系如图所示。下列说法不正确的是
A.25℃时, 的数量级为 的数量级为 |
B.当 时: 时: |
C.曲线②中的 |
D.当滴入体积 mL时,溶液 mL时,溶液 |
您最近一年使用:0次
名校
解题方法
7 . “宏观辨识与微观探析”是学科核心素养之一,下列离子方程式正确且符合题意的是
A.“84消毒液”具有漂白作用: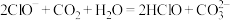 |
B.用铜片作电极,电解饱和食盐水: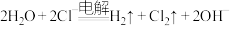 |
C.赤血盐溶液滴入FeSO4溶液中: |
D.向过量的NaHSO3溶液中滴加少量溴水: |
您最近一年使用:0次
解题方法
8 . 常温下,向0.1mol∙L-1二元弱酸H2A溶液中逐滴加入NaOH溶液,H2A、HA-、A2-的物质的量分数[已知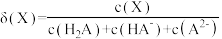 ]。随pH的变化如图所示。下列叙述正确的是
]。随pH的变化如图所示。下列叙述正确的是
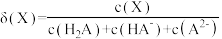 ]。随pH的变化如图所示。下列叙述正确的是
]。随pH的变化如图所示。下列叙述正确的是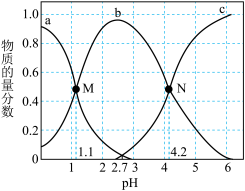
| A.a曲线代表A2-的物质的量分数随pH的变化 |
| B.溶液pH=1时的导电能力强于pH=6时的导电能力 |
| C.H2A第二步电离常数Ka2=10-4.2 |
| D.N点pH=4.2时,c(A2-)=c(HA-),溶液中不存在H2A分子 |
您最近一年使用:0次
9 . 室温时,向 20 mL 0.1 mol·L-1的 HA、HB 溶液中分别滴加 0.1 mol·L-1NaOH溶液,其 pH 变化分别对应如图中的Ⅰ、Ⅱ。下列说法不正确的是

| A.向 NaA 溶液中滴加 HB 溶液可产生 HA |
| B.加入 10mlNaOH 溶液时,HA 的导电性弱于 HB |
| C.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)=c(B-) |
| D.滴加 20 mL NaOH 溶液时,Ⅰ中 H2O 的电离程度大于Ⅱ中 |
您最近一年使用:0次
10 . 研究水溶液中的粒子行为在研究中具有重要价值。
根据下表所列三种溶液在25℃时的相关数据,按要求填空:
(1)用离子方程式表示CH3COOH溶液显酸性的原因 ___________ 。
(2)比较溶液(Ⅱ)、(Ⅲ)中 的大小关系是(Ⅱ)
的大小关系是(Ⅱ)___________ (Ⅲ)(填“>”、“<”或“=”)。
(3)溶液(Ⅱ)中各离子浓度由大到小的顺序是___________ 。
(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的 之比是
之比是 ___________ 。
根据下表所列三种溶液在25℃时的相关数据,按要求填空:
| 溶液 | 物质的量浓度 | pH | 用离子方程式表示溶液显酸性的原因 |
| (Ⅰ)CH3COOH | 0.1mol/L | 3 | _______ |
| (Ⅱ)NH4Cl | 0.1mol/L | 6 | / |
| (Ⅲ)NH4HSO4 | 0.1mol/L | 1 | / |
(2)比较溶液(Ⅱ)、(Ⅲ)中
 的大小关系是(Ⅱ)
的大小关系是(Ⅱ)(3)溶液(Ⅱ)中各离子浓度由大到小的顺序是
(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的
 之比是
之比是
您最近一年使用:0次



