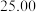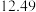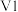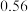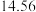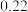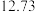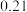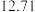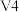解题方法
1 . 工业上从金矿中提炼黄金可以采用氰化法,即:用NaCN稀溶液浸取粉碎的金矿石,生成溶于水的配位化合物Na[Au(CN)2],再用Zn置换出Au,产生的含氰废水经处理后排放。已知:HCN剧毒,易挥发,25℃时Ka(HCN)=4.0×10−10。
(1)配离子[Au(CN)2]−中的中心离子是___________ ,配体是___________ 。
(2)Zn位于元素周期表的第4周期第___________族。
(3)配制NaCN溶液时,将NaCN固体溶于___________溶液中,再用蒸馏水稀释。
(4)25℃时,等浓度等体积NaCN与HCN混合后溶液的pH>7,原因是___________ 。
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式___________ 。
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。
①CN−中各原子均达到8电子稳定结构,写出CN−的电子式___________ 。
②将上述离子方程式补充完整并配平。___________
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为___________ 。(NA表示阿伏加德罗常数)
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是___________ 。
(1)配离子[Au(CN)2]−中的中心离子是
(2)Zn位于元素周期表的第4周期第___________族。
| A.IIA | B.IIB | C.0 | D.12 |
| A.HCl | B.KOH | C.NaCl | D.NaOH |
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO
 +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。①CN−中各原子均达到8电子稳定结构,写出CN−的电子式
②将上述离子方程式补充完整并配平。
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是
您最近一年使用:0次
名校
2 . 25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)HCOOH、 、HCN的酸性由强到弱的顺序为
、HCN的酸性由强到弱的顺序为______ 。
(2)向 溶液中加入足量HCN,反应的离子方程式为
溶液中加入足量HCN,反应的离子方程式为______ 。
(3)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.000mol/L的NaOH标准溶液滴定:
①用NaOH固体配制100mL,1.000mol/L的NaOH溶液,需要用到的仪器 除天平,药匙,烧杯,玻璃棒,胶头滴管,还需要______ 。实验过程中,将25.00mLHCOOH放入锥形瓶,滴入酚酞2-3滴;用标准NaOH溶液进行滴定,滴定过程中,眼睛应注视______ 。
②连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为______ mL。
依据上表数据计算该HCOOH溶液的物质的量浓度为______ mol/L(计算结果保留四位有效数字)。
④下列操作中可能使所测HCOOH溶液的浓度数值偏低的是______ (填字母)。
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定法是一种常见的定量实验分析法,常见的滴定有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
①如据反应 ,可以用碘水滴定
,可以用碘水滴定 溶液,可以选
溶液,可以选______ 作指示剂;
②用 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点,当溶液中的
反应生成砖红色沉淀指示滴定终点,当溶液中的 恰好沉淀完全(浓度为
恰好沉淀完全(浓度为 )时,溶液中的
)时,溶液中的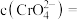
______  。(已知25℃时,
。(已知25℃时, 和AgCl的
和AgCl的 分别为
分别为 和
和 。)
。)
化学式 |
|
|
|
电离平衡常数 |
|
|
|
(1)HCOOH、
 、HCN的酸性由强到弱的顺序为
、HCN的酸性由强到弱的顺序为(2)向
 溶液中加入足量HCN,反应的离子方程式为
溶液中加入足量HCN,反应的离子方程式为(3)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.000mol/L的NaOH标准溶液滴定:
①用NaOH固体配制100mL,1.000mol/L的NaOH溶液,需要用到的
②连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为
实验序号 | 待测 |
| ||
滴定前刻度 | 滴定后刻度 | 溶液的体积 | ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
④下列操作中可能使所测HCOOH溶液的浓度数值偏低的是
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定法是一种常见的定量实验分析法,常见的滴定有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
①如据反应
 ,可以用碘水滴定
,可以用碘水滴定 溶液,可以选
溶液,可以选②用
 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点,当溶液中的
反应生成砖红色沉淀指示滴定终点,当溶液中的 恰好沉淀完全(浓度为
恰好沉淀完全(浓度为 )时,溶液中的
)时,溶液中的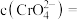
 。(已知25℃时,
。(已知25℃时, 和AgCl的
和AgCl的 分别为
分别为 和
和 。)
。)
您最近一年使用:0次
3 . 已知: ,
, 。25℃时,向
。25℃时,向 溶液中滴加
溶液中滴加 的NaOH溶液。溶液中
的NaOH溶液。溶液中 与加入NaOH溶液体积的关系如图所示。下列说法
与加入NaOH溶液体积的关系如图所示。下列说法错误 的是
 ,
, 。25℃时,向
。25℃时,向 溶液中滴加
溶液中滴加 的NaOH溶液。溶液中
的NaOH溶液。溶液中 与加入NaOH溶液体积的关系如图所示。下列说法
与加入NaOH溶液体积的关系如图所示。下列说法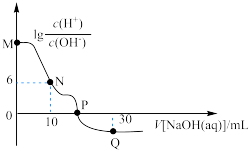
A.M点溶液中存在: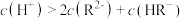 |
B.25℃时.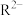 的水解常数 的水解常数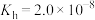 |
| C.P点加入NaOH溶液的体积小于20mL |
D.Q点溶液中存在: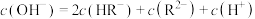 |
您最近一年使用:0次
名校
4 . 向100mL NaOH溶液中通入一定量 充分反应后,向所得溶液中,逐滴滴加1mol/L的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
充分反应后,向所得溶液中,逐滴滴加1mol/L的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。 充分反应后,所得溶液的溶质为
充分反应后,所得溶液的溶质为___________ (填化学式)。
(2)已知25℃碳酸的 ,
, ,忽略
,忽略 和
和 浓度的变化,在滴加盐酸前,此时溶液pH=
浓度的变化,在滴加盐酸前,此时溶液pH=___________ 。
(3)关于该溶液的表达式正确的是___________。
 充分反应后,向所得溶液中,逐滴滴加1mol/L的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
充分反应后,向所得溶液中,逐滴滴加1mol/L的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
 充分反应后,所得溶液的溶质为
充分反应后,所得溶液的溶质为(2)已知25℃碳酸的
 ,
, ,忽略
,忽略 和
和 浓度的变化,在滴加盐酸前,此时溶液pH=
浓度的变化,在滴加盐酸前,此时溶液pH=(3)关于该溶液的表达式正确的是___________。
A. |
B. |
C. |
D. |
您最近一年使用:0次
名校
5 . 已知:25℃时, 的电离平衡常数
的电离平衡常数 、
、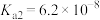 。某小组同学用
。某小组同学用 溶液吸收
溶液吸收 得到吸收液w。
得到吸收液w。
1.请根据上述数据判断 溶液呈
溶液呈___________ (填“酸性”、“碱性”、“中性”),理由是:___________ 。
2.当吸收液w呈中性时,溶液中
___________  。
。
A. B.
B. C.
C.
 的电离平衡常数
的电离平衡常数 、
、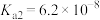 。某小组同学用
。某小组同学用 溶液吸收
溶液吸收 得到吸收液w。
得到吸收液w。1.请根据上述数据判断
 溶液呈
溶液呈2.当吸收液w呈中性时,溶液中

 。
。A.
 B.
B. C.
C.
您最近一年使用:0次
6 . 自然界中含 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、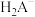 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:__________ (写出其中一个离子方程式即可);加热能降低这种硬水中的 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为_________ 。
(2)表示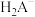 变化曲线的是
变化曲线的是_______ (填字母标号); 为
为_______ 。
(3)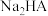 溶液显
溶液显____ (填“酸性”、“中性”或“碱性”),溶液中的电荷守恒关系式为________ 。
(4)向硬水中加入NaF固体可除去溶液中的 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为________  。[已知
。[已知 ,
,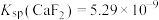 ]
]
 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、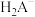 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:
 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为(2)表示
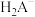 变化曲线的是
变化曲线的是 为
为(3)
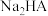 溶液显
溶液显(4)向硬水中加入NaF固体可除去溶液中的
 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为 。[已知
。[已知 ,
,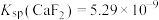 ]
]
您最近一年使用:0次
7 . 完成下列问题。
(1) 水溶液呈酸性的原因是(用离子方程式表示):
水溶液呈酸性的原因是(用离子方程式表示):________ 。
(2)室温时, 的
的 溶液中由水电离出的
溶液中由水电离出的
______  。
。
(3)室温时, 的Ba(OH)2溶液,
的Ba(OH)2溶液,
________ 。
(4)室温下pH=3的 水溶液水电离的c(H+)
水溶液水电离的c(H+)______  。
。
(5)常温下pH=13的 溶液与pH=11
溶液与pH=11 溶液等体积混合,混合溶液pH=
溶液等体积混合,混合溶液pH=______ 。
(6)常温下0.1 的NH3·H2O,pH=11,则Kb=
的NH3·H2O,pH=11,则Kb=_______ ,常温下0.1 的CH3COOH溶液pH=3 ,则Ka=
的CH3COOH溶液pH=3 ,则Ka=_______ 。
(1)
 水溶液呈酸性的原因是(用离子方程式表示):
水溶液呈酸性的原因是(用离子方程式表示):(2)室温时,
 的
的 溶液中由水电离出的
溶液中由水电离出的
 。
。(3)室温时,
 的Ba(OH)2溶液,
的Ba(OH)2溶液,
(4)室温下pH=3的
 水溶液水电离的c(H+)
水溶液水电离的c(H+) 。
。(5)常温下pH=13的
 溶液与pH=11
溶液与pH=11 溶液等体积混合,混合溶液pH=
溶液等体积混合,混合溶液pH=(6)常温下0.1
 的NH3·H2O,pH=11,则Kb=
的NH3·H2O,pH=11,则Kb= 的CH3COOH溶液pH=3 ,则Ka=
的CH3COOH溶液pH=3 ,则Ka=
您最近一年使用:0次
8 . 已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,pH相同的三种溶液①NaF溶液;②NaClO溶液;③Na2CO3溶液,其物质的量浓度由大到小的顺序是_______ 。(填序号)
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_______ 。
(3)室温下,经测定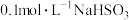 溶液
溶液 ,则
,则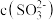
_______  (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。
(4) 时,将
时,将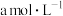 的氨水与
的氨水与 的盐酸等体积混合所得溶液中
的盐酸等体积混合所得溶液中 ,则溶液显
,则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离平衡常数
的电离平衡常数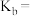
_______ 。
(5)将含 的烟气通入该氨水中,当溶液显中性时,溶液中
的烟气通入该氨水中,当溶液显中性时,溶液中
_______ 。
| 化学式 |  |  |  |  |  |
| 电离常数 |  |  |  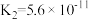 | 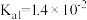 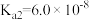 | 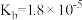 |
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式
(3)室温下,经测定
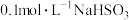 溶液
溶液 ,则
,则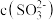
 (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。(4)
 时,将
时,将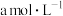 的氨水与
的氨水与 的盐酸等体积混合所得溶液中
的盐酸等体积混合所得溶液中 ,则溶液显
,则溶液显 的电离平衡常数
的电离平衡常数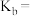
(5)将含
 的烟气通入该氨水中,当溶液显中性时,溶液中
的烟气通入该氨水中,当溶液显中性时,溶液中
您最近一年使用:0次
名校
9 . 柠檬酸是一种重要的工业原料,化学式可表示为 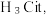 属于三元弱酸。 25℃时,柠檬酸的电离常数分别为:
属于三元弱酸。 25℃时,柠檬酸的电离常数分别为: 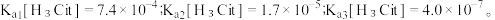
(1)25℃时, 不同pH范围内,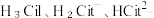 和
和 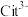 所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表
所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表  的曲线是
的曲线是_______ 。
(3)已知25℃时,碳酸的电离常数为: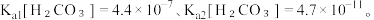 向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式_______ 。
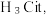 属于三元弱酸。 25℃时,柠檬酸的电离常数分别为:
属于三元弱酸。 25℃时,柠檬酸的电离常数分别为: 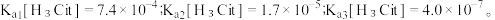
(1)25℃时, 不同pH范围内,
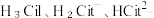 和
和 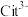 所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表
所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表  的曲线是
的曲线是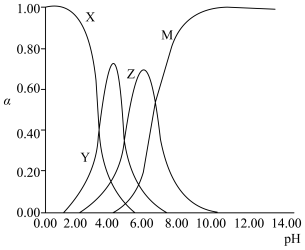
A.Na3Cit溶液中, |
B.Na3Cit溶液中,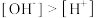 |
C.NaH2Cit溶液中, |
D.Na2HCit溶液中,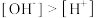 |
(3)已知25℃时,碳酸的电离常数为:
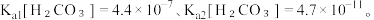 向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
您最近一年使用:0次
解题方法
10 . 电解质的水溶液中存在电离平衡。
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为_______ 。
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)________ 。
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。_______ 。
②滴定醋酸的曲线是_______ (填“I”或“Ⅱ”),则V1______ V2(填“>”、 “<”“或“=”)。
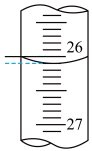
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为_____ mL。 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①该滴定过程应选择______ (填“甲基橙”或“酚酞”)为指示剂,根据上述数据,可计算出该醋酸的浓度约为_____  。
。
②在上述实验中,下列操作会造成测定结果偏大的有______ 。(填字母序号)。
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为
 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。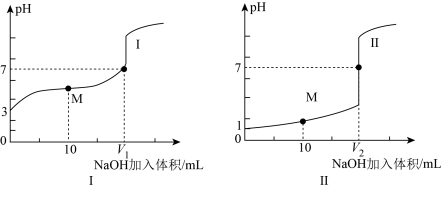
②滴定醋酸的曲线是
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为

 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测醋酸的体积(mL) |
| 1 | 0.1000 | 22.48 | 20.00 |
| 2 | 0.1000 | 25.72 | 20.00 |
| 3 | 0.1000 | 22.52 | 20.00 |
 。
。②在上述实验中,下列操作会造成测定结果偏大的有
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次

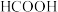

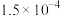
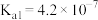
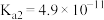

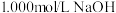 的体积
的体积