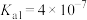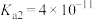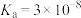解题方法
1 . 工业上从金矿中提炼黄金可以采用氰化法,即:用NaCN稀溶液浸取粉碎的金矿石,生成溶于水的配位化合物Na[Au(CN)2],再用Zn置换出Au,产生的含氰废水经处理后排放。已知:HCN剧毒,易挥发,25℃时Ka(HCN)=4.0×10−10。
(1)配离子[Au(CN)2]−中的中心离子是___________ ,配体是___________ 。
(2)Zn位于元素周期表的第4周期第___________族。
(3)配制NaCN溶液时,将NaCN固体溶于___________溶液中,再用蒸馏水稀释。
(4)25℃时,等浓度等体积NaCN与HCN混合后溶液的pH>7,原因是___________ 。
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式___________ 。
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。
①CN−中各原子均达到8电子稳定结构,写出CN−的电子式___________ 。
②将上述离子方程式补充完整并配平。___________
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为___________ 。(NA表示阿伏加德罗常数)
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是___________ 。
(1)配离子[Au(CN)2]−中的中心离子是
(2)Zn位于元素周期表的第4周期第___________族。
| A.IIA | B.IIB | C.0 | D.12 |
| A.HCl | B.KOH | C.NaCl | D.NaOH |
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO
 +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。①CN−中各原子均达到8电子稳定结构,写出CN−的电子式
②将上述离子方程式补充完整并配平。
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是
您最近一年使用:0次
名校
2 . 已知:25℃时, 的电离平衡常数
的电离平衡常数 、
、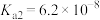 。某小组同学用
。某小组同学用 溶液吸收
溶液吸收 得到吸收液w。
得到吸收液w。
1.请根据上述数据判断 溶液呈
溶液呈___________ (填“酸性”、“碱性”、“中性”),理由是:___________ 。
2.当吸收液w呈中性时,溶液中
___________  。
。
A. B.
B. C.
C.
 的电离平衡常数
的电离平衡常数 、
、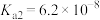 。某小组同学用
。某小组同学用 溶液吸收
溶液吸收 得到吸收液w。
得到吸收液w。1.请根据上述数据判断
 溶液呈
溶液呈2.当吸收液w呈中性时,溶液中

 。
。A.
 B.
B. C.
C.
您最近一年使用:0次
3 . 自然界中含 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、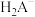 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:__________ (写出其中一个离子方程式即可);加热能降低这种硬水中的 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为_________ 。
(2)表示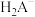 变化曲线的是
变化曲线的是_______ (填字母标号); 为
为_______ 。
(3)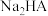 溶液显
溶液显____ (填“酸性”、“中性”或“碱性”),溶液中的电荷守恒关系式为________ 。
(4)向硬水中加入NaF固体可除去溶液中的 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为________  。[已知
。[已知 ,
,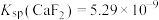 ]
]
 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、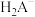 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:
 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为(2)表示
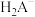 变化曲线的是
变化曲线的是 为
为(3)
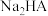 溶液显
溶液显(4)向硬水中加入NaF固体可除去溶液中的
 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为 。[已知
。[已知 ,
,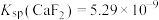 ]
]
您最近一年使用:0次
4 . 柠檬酸(俗称枸橼酸,用H3R表示)是易溶于水的无色晶体,一种有机弱酸,可作酸度调节剂、防腐剂等。其结构简式和各级电离平衡常数如下表:
(1)柠檬酸的第二步电离方程式为_______。
(2)某泡腾片是以柠檬酸和碳酸氢钠泡腾崩解剂,将其置入水中才会发生泡腾反应,主要原因是其加入水中,两种电解质发生了_______。
| 结构简式 |  |  | 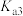 |
|  | 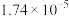 | 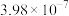 |
(1)柠檬酸的第二步电离方程式为_______。
A.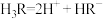 | B. |
C. | D. |
(2)某泡腾片是以柠檬酸和碳酸氢钠泡腾崩解剂,将其置入水中才会发生泡腾反应,主要原因是其加入水中,两种电解质发生了_______。
| A.电解 | B.电离 | C.水解 | D.分解 |
您最近一年使用:0次
名校
5 . 磷能形成次磷酸 、亚磷酸
、亚磷酸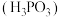 、磷酸
、磷酸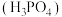 等多种含氧酸,完成下列问题。
等多种含氧酸,完成下列问题。
(1)①已知 是一元弱酸,书写
是一元弱酸,书写 的电离方程式:
的电离方程式:_______ 。
②以下可以证明 是弱酸的是
是弱酸的是_______ 。
A. 溶液与碳酸钙反应,缓慢放出二氧化碳
溶液与碳酸钙反应,缓慢放出二氧化碳
B. 溶液导电能力很弱
溶液导电能力很弱
C.常温时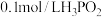 溶液的
溶液的 大于1
大于1
D. 溶液可以使石蕊变红
溶液可以使石蕊变红
(2)亚磷酸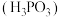 是二元弱酸,
是二元弱酸, 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。
(3)磷酸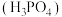 是三元弱酸,
是三元弱酸, 溶液中含磷酸根浓度由大到小排第二位的微粒符号是
溶液中含磷酸根浓度由大到小排第二位的微粒符号是_______ 。
 、亚磷酸
、亚磷酸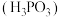 、磷酸
、磷酸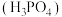 等多种含氧酸,完成下列问题。
等多种含氧酸,完成下列问题。(1)①已知
 是一元弱酸,书写
是一元弱酸,书写 的电离方程式:
的电离方程式:②以下可以证明
 是弱酸的是
是弱酸的是A.
 溶液与碳酸钙反应,缓慢放出二氧化碳
溶液与碳酸钙反应,缓慢放出二氧化碳 B.
 溶液导电能力很弱
溶液导电能力很弱C.常温时
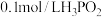 溶液的
溶液的 大于1
大于1 D.
 溶液可以使石蕊变红
溶液可以使石蕊变红(2)亚磷酸
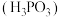 是二元弱酸,
是二元弱酸, 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:(3)磷酸
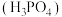 是三元弱酸,
是三元弱酸, 溶液中含磷酸根浓度由大到小排第二位的微粒符号是
溶液中含磷酸根浓度由大到小排第二位的微粒符号是
您最近一年使用:0次
解题方法
6 . 草酸 是一种白色粉末,
是一种白色粉末,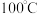 左右开始少量升华,熔点为
左右开始少量升华,熔点为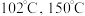 左右分解产生
左右分解产生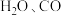 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为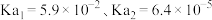 。
。
1.草酸可用于实验室制备少量 气体,应选择的发生装置为
气体,应选择的发生装置为___________ 。
常温下,向某浓度的草酸溶液中加入一定量等浓度的 溶液。
溶液。
3.当 时,溶液呈___________。
时,溶液呈___________。
A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中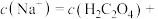
___________ 。
4.当 时,计算该溶液的
时,计算该溶液的
___________ 。(结果保留两位小数)计算过程。
 是一种白色粉末,
是一种白色粉末,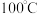 左右开始少量升华,熔点为
左右开始少量升华,熔点为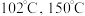 左右分解产生
左右分解产生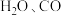 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为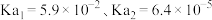 。
。1.草酸可用于实验室制备少量
 气体,应选择的发生装置为
气体,应选择的发生装置为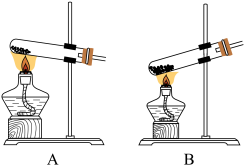
A.用足量的 溶液充分吸收后,可收集得到纯净的 溶液充分吸收后,可收集得到纯净的 |
| B.通过灼热的氧化铜,若出现黑色变红色现象,则产生的气体中一定有CO |
C.通入足量的澄清石灰水中,若能产生白色沉淀,则产生的气体中一定有 |
D.通入酸性 溶液中,若能使溶液褪色,说明草酸具有还原性 溶液中,若能使溶液褪色,说明草酸具有还原性 |
常温下,向某浓度的草酸溶液中加入一定量等浓度的
 溶液。
溶液。3.当
 时,溶液呈___________。
时,溶液呈___________。A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中
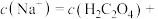
4.当
 时,计算该溶液的
时,计算该溶液的
您最近一年使用:0次
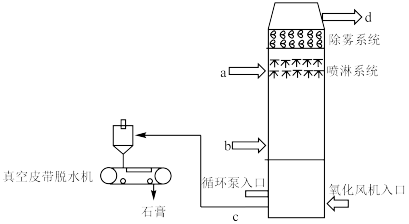
7 . 下图是石灰石膏法脱硫的示意图。烟气在脱硫塔内与脱硫剂(石灰石/生石灰浆液)接触混合,继而与鼓入的空气中的氧气发生化学反应,生成石膏(CaSO4·2H2O)。脱硫后的烟气经过除雾器除去雾滴后,排至大气。
1.烟气进口:_____ 。(填a或b)
2.为避免操作不当引起的中间产物CaSO3结垢和堵塞现象,某公司在脱硫剂中加入少量甲酸,效果很好。写出少量甲酸和CaSO3反应的化学方程式:_____ 。
| HCOOH | Ka=1.80×10-4 | |
| H2SO3 | Ka1=1.2×10-2 | Ka2=6.2×10-8 |
| H2CO3 | Ka1=4.2×10-7 | Ka2=4.8×10-11 |
1.烟气进口:
2.为避免操作不当引起的中间产物CaSO3结垢和堵塞现象,某公司在脱硫剂中加入少量甲酸,效果很好。写出少量甲酸和CaSO3反应的化学方程式:
您最近一年使用:0次
8 . 生物质铁炭纳米材料可以活化过一硫酸盐,降解废水中有机污染物.
(1)生物质铁炭纳米材料活化过—硫酸钾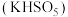 降解有机污染物的反应历程如图-1所示.图中
降解有机污染物的反应历程如图-1所示.图中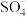 和
和 分别表示硫酸根自由基和羟基自由基.
分别表示硫酸根自由基和羟基自由基. (S的化合价为
(S的化合价为 )在水中的电离过程为:
)在水中的电离过程为: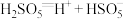 、
、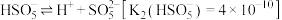 .写出
.写出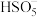 的结构式:
的结构式:_______ 。
②生物质铁炭纳米材料降解有机污染物的机理可描述为______ 。
③若有机污染物为苯酚,写出酸性条件下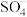 与苯酚反应的化学方程式:
与苯酚反应的化学方程式:______ 。
(2)与直接使用纳米铁颗粒相比,使用生物质铁炭纳米材料降解的优点是:______ 。
(3)铁炭纳米材料在不同 对有机污染物去除率(
对有机污染物去除率( 溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示,
溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示, 越小有机污染物去除率越高的原因是:
越小有机污染物去除率越高的原因是:______ 。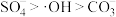 。水中存在一定量
。水中存在一定量 和无
和无 存在时对铁炭纳米材料降解有机污染物的影响如图-3所示.
存在时对铁炭纳米材料降解有机污染物的影响如图-3所示. 的存在对有机污染物的降解有影响,原因是:
的存在对有机污染物的降解有影响,原因是:______ 。
(1)生物质铁炭纳米材料活化过—硫酸钾
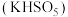 降解有机污染物的反应历程如图-1所示.图中
降解有机污染物的反应历程如图-1所示.图中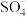 和
和 分别表示硫酸根自由基和羟基自由基.
分别表示硫酸根自由基和羟基自由基.
 (S的化合价为
(S的化合价为 )在水中的电离过程为:
)在水中的电离过程为: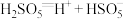 、
、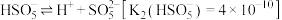 .写出
.写出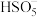 的结构式:
的结构式:②生物质铁炭纳米材料降解有机污染物的机理可描述为
③若有机污染物为苯酚,写出酸性条件下
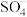 与苯酚反应的化学方程式:
与苯酚反应的化学方程式:(2)与直接使用纳米铁颗粒相比,使用生物质铁炭纳米材料降解的优点是:
(3)铁炭纳米材料在不同
 对有机污染物去除率(
对有机污染物去除率( 溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示,
溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示, 越小有机污染物去除率越高的原因是:
越小有机污染物去除率越高的原因是: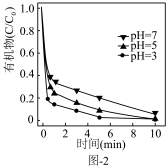
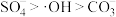 。水中存在一定量
。水中存在一定量 和无
和无 存在时对铁炭纳米材料降解有机污染物的影响如图-3所示.
存在时对铁炭纳米材料降解有机污染物的影响如图-3所示. 的存在对有机污染物的降解有影响,原因是:
的存在对有机污染物的降解有影响,原因是: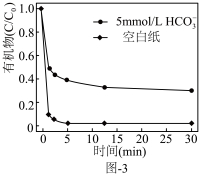
您最近一年使用:0次
9 . 回答下列问题
(1)现有a. b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
①相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a_________ b。
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a_________ b。
将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a_________ b。
(2)常温下,根据表中的几种物质的电离平衡常数回答下列问题:
①下列反应不能发生的是_________ (填序号)。
a.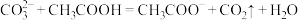
b.
c.
d.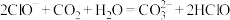
②反应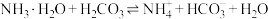 的平衡常数K=
的平衡常数K=_________ 。
(3)常温下,浓度均为0.1 的下列五种钠盐溶液的pH如下表:
的下列五种钠盐溶液的pH如下表:
①上述盐溶液中的阴离子,结合 能力最强的是
能力最强的是 _________ 。
②根据表中数据,浓度均为0.01 的下列四种酸的溶液分别稀释100倍,pH变化最大的是
的下列四种酸的溶液分别稀释100倍,pH变化最大的是_________ (填编号)。
A.HCN B.HClO C. D.
D.
(4)①已知t℃时,0.01 NaOH溶液的pH=11,0.1
NaOH溶液的pH=11,0.1 的HA溶液中
的HA溶液中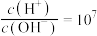 。该温度下,0.1
。该温度下,0.1 HA溶液中水电离出的
HA溶液中水电离出的
_________ 。
②25℃时,将体积 、pH=a的某一元强碱与体积为
、pH=a的某一元强碱与体积为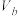 、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
_________ 。
③25℃时,pH=5的醋酸和pH=5的 溶液中由水电离出的
溶液中由水电离出的 浓度之比为
浓度之比为_________ 。
(1)现有a.
 b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。①相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a
将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a
(2)常温下,根据表中的几种物质的电离平衡常数回答下列问题:
弱酸 |
|
|
| HClO |
电离平衡常数 |
|
|
|
|
a.
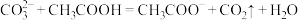
b.

c.

d.
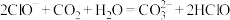
②反应
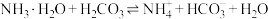 的平衡常数K=
的平衡常数K=(3)常温下,浓度均为0.1
 的下列五种钠盐溶液的pH如下表:
的下列五种钠盐溶液的pH如下表:溶质 |
|
|
| NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
 能力最强的是
能力最强的是 ②根据表中数据,浓度均为0.01
 的下列四种酸的溶液分别稀释100倍,pH变化最大的是
的下列四种酸的溶液分别稀释100倍,pH变化最大的是A.HCN B.HClO C.
 D.
D.
(4)①已知t℃时,0.01
 NaOH溶液的pH=11,0.1
NaOH溶液的pH=11,0.1 的HA溶液中
的HA溶液中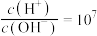 。该温度下,0.1
。该温度下,0.1 HA溶液中水电离出的
HA溶液中水电离出的
②25℃时,将体积
 、pH=a的某一元强碱与体积为
、pH=a的某一元强碱与体积为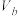 、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
③25℃时,pH=5的醋酸和pH=5的
 溶液中由水电离出的
溶液中由水电离出的 浓度之比为
浓度之比为
您最近一年使用:0次
10 . 研究水质除砷技术对保护环境有重要意义。
已知:As(V)在不同pH条件下的物种分布分数如图1所示。
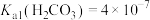 ,
,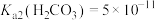 ;
;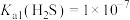 ,
,
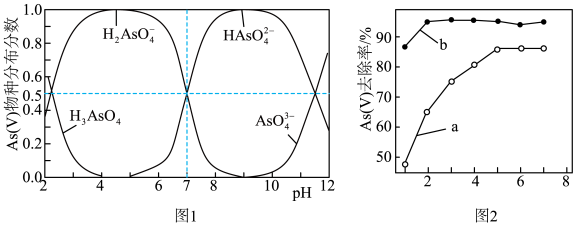
(1)硫化法:As(Ⅲ)能与硫化剂(能提供 )反应生成雌黄(
)反应生成雌黄( )沉淀。HCHO能在硫酸盐还原菌的作用下将
)沉淀。HCHO能在硫酸盐还原菌的作用下将 还原为
还原为 ,同时生成
,同时生成 。
。
①沉淀1 mol As(Ⅲ)理论上需消耗HCHO的物质的量为______ mol。
② 能与
能与 反应:
反应: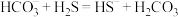 。该反应的平衡常数
。该反应的平衡常数
______ 。
(2)石灰沉淀法:向含砷(V)废水中添加石灰水,可使砷元素转化为多种砷酸钙盐沉淀。
①向中性废水中加入适量石灰水,使As(V)完全转化为 沉淀。写出该反应的离子方程式:
沉淀。写出该反应的离子方程式:____________ 。
②向含 沉淀的悬浊液中通入
沉淀的悬浊液中通入 气体,可得到
气体,可得到 。该转化能实现的原因是
。该转化能实现的原因是____________ 。
③控制其他条件不变,向碱性含砷(V)废水中加入一定量石灰水,测得As(V)去除率在30℃以后随温度升高而降低。可能的原因是__________________ 。
④在初始pH、c[As(V)]相同的模拟废水中加入石灰水,As(V)去除率随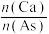 的变化如图2曲线a所示;固定
的变化如图2曲线a所示;固定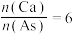 ,往石灰水中添加Fe(Ⅲ)盐,As(V)去除率随
,往石灰水中添加Fe(Ⅲ)盐,As(V)去除率随 的变化如图2曲线b所示。加入Fe(Ⅲ)盐后,As(V)去除率增大的原因是
的变化如图2曲线b所示。加入Fe(Ⅲ)盐后,As(V)去除率增大的原因是____________ 。
已知:As(V)在不同pH条件下的物种分布分数如图1所示。
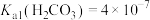 ,
,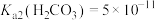 ;
;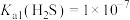 ,
,

(1)硫化法:As(Ⅲ)能与硫化剂(能提供
 )反应生成雌黄(
)反应生成雌黄( )沉淀。HCHO能在硫酸盐还原菌的作用下将
)沉淀。HCHO能在硫酸盐还原菌的作用下将 还原为
还原为 ,同时生成
,同时生成 。
。①沉淀1 mol As(Ⅲ)理论上需消耗HCHO的物质的量为
②
 能与
能与 反应:
反应: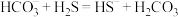 。该反应的平衡常数
。该反应的平衡常数
(2)石灰沉淀法:向含砷(V)废水中添加石灰水,可使砷元素转化为多种砷酸钙盐沉淀。
①向中性废水中加入适量石灰水,使As(V)完全转化为
 沉淀。写出该反应的离子方程式:
沉淀。写出该反应的离子方程式:②向含
 沉淀的悬浊液中通入
沉淀的悬浊液中通入 气体,可得到
气体,可得到 。该转化能实现的原因是
。该转化能实现的原因是③控制其他条件不变,向碱性含砷(V)废水中加入一定量石灰水,测得As(V)去除率在30℃以后随温度升高而降低。可能的原因是
④在初始pH、c[As(V)]相同的模拟废水中加入石灰水,As(V)去除率随
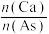 的变化如图2曲线a所示;固定
的变化如图2曲线a所示;固定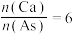 ,往石灰水中添加Fe(Ⅲ)盐,As(V)去除率随
,往石灰水中添加Fe(Ⅲ)盐,As(V)去除率随 的变化如图2曲线b所示。加入Fe(Ⅲ)盐后,As(V)去除率增大的原因是
的变化如图2曲线b所示。加入Fe(Ⅲ)盐后,As(V)去除率增大的原因是
您最近一年使用:0次