1 . 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法不正确 的是
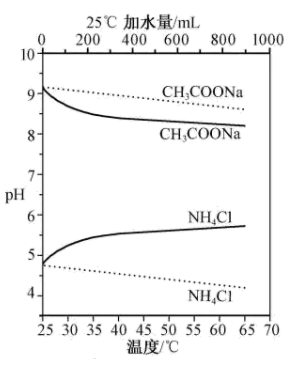

| A.图中 |
B.将NH4Cl溶液加水稀释至浓度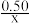 mol·L-1,溶液pH变化值小于lgx mol·L-1,溶液pH变化值小于lgx |
| C.随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 |
D.25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH ) ) |
您最近一年使用:0次
2021-01-09更新
|
9091次组卷
|
31卷引用:北京市第一○一中学2023届高三下学期三模化学试题
北京市第一○一中学2023届高三下学期三模化学试题(已下线)2021年1月浙江高考化学试题变式题21-252021年湖北高考化学试题变式题11-19浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题(已下线)T12-电解质溶液2021年1月新高考浙江化学高考真题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)难点7 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题15.离子反应图象-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 盐类的水解山西大学附属中学校2022-2023学年高三上学期11月期中考试化学试题
名校
2 .  是一种优良的水处理剂。25℃,其水溶液中加酸加碱改变溶液的pH时,含R粒子的物质的量分数
是一种优良的水处理剂。25℃,其水溶液中加酸加碱改变溶液的pH时,含R粒子的物质的量分数 [
[ ]随pH的变化如图所示。下列说法不正确的是
]随pH的变化如图所示。下列说法不正确的是

 是一种优良的水处理剂。25℃,其水溶液中加酸加碱改变溶液的pH时,含R粒子的物质的量分数
是一种优良的水处理剂。25℃,其水溶液中加酸加碱改变溶液的pH时,含R粒子的物质的量分数 [
[ ]随pH的变化如图所示。下列说法不正确的是
]随pH的变化如图所示。下列说法不正确的是
A.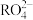 中R为 中R为 价,pH>6时溶液中存在 价,pH>6时溶液中存在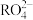 |
| B.水的电离程度:M<N |
C.溶液中存在: |
D.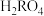 的第一步电离平衡常数 的第一步电离平衡常数 |
您最近一年使用:0次
2022-03-01更新
|
1124次组卷
|
9卷引用:北京市通州区2022届高三查缺补漏化学试题
北京市通州区2022届高三查缺补漏化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题广东省汕头市2022届高三下学期第一次模拟考试化学试题(已下线)【直击双一流】07-备战2022年高考化学名校进阶模拟卷(通用版)广东省揭阳市、丰顺2022届高三下学期3月联考化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)浙江省杭州第四中学2022-2023学年高二上学期期中考试 化学试题
名校
解题方法
3 . 常温下,用0.20mol·L-1盐酸滴定25.00mL0.20mol·L-1NH3·H2O溶液,所得溶液的pH、NH4+和NH3·H2O的物质的量分数(x)与滴加盐酸体积的关系如图所示。下列说法不正确 的是
| A.曲线①代表x(NH3·H2O) |
| B.当溶液显中性时,滴入盐酸的体积小于25.00mL |
| C.NH3·H2O的电离常数约为1×10-9.26 |
D.a点的溶液中存在c(NH )=c(NH3·H2O)>c(Cl-) )=c(NH3·H2O)>c(Cl-) |
您最近一年使用:0次
2024-04-15更新
|
512次组卷
|
3卷引用:北京市朝阳区2023-2024学年高三下学期一模化学试题
4 . 醋酸的电离方程式为CH3COOH(aq)⇌CH3COO-(aq)+H+(aq) ΔH>0,25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=1.75×10-5,是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是
| A.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)增大 |
| B.向该溶液中加少量CH3COONa固体,平衡逆向移动 |
| C.该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 |
| D.升高温度,c(H+)增大,Ka变大 |
您最近一年使用:0次
2021-10-18更新
|
1154次组卷
|
7卷引用:2020年北京高考化学真题变式题1-10
2020年北京高考化学真题变式题1-10吉林省长春北师大附属学校2021-2022学年高二上学期第一次月考化学试题(已下线)必考点05 电离平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)四川省绵阳南山中学2021-2022学年高二上学期12月月考化学试题河北省衡水市第十四中学(西校区)2021-2022学年高二上学期二调考试化学试题广东深圳市第二外国语学校2021-2022学年高二上学期期中测试化学试题广东省潮州湘桥区南春中学2021-2022学年高二上学期期中考试化学试题
名校
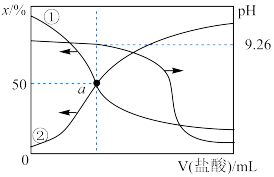
5 . “84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法并测定相关反应的平衡常数。
资料:i.HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11
ii.碘的化合物主要以I-和 的形式存在,
的形式存在, +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-
 (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。
I制备消毒液(夹持装置略)
(1)制备NaClO的离子反应方程式___________ 。
(2)结合资料i,写出D中反应的化学方程式___________ 。
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(3)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为 。
。
设计实验a证实了假设1成立。NaClO氧化I2生成 的离子方程式是
的离子方程式是___________ 。
假设2:生成的I2在碱性溶液中不能存在。
设计实验b证实了假设2成立,实验b的操作及现象是___________ 。
(4)某小组检验烧杯3所得溶液中含 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由___________ 。
(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据___________ 。
资料:i.HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11
ii.碘的化合物主要以I-和
 的形式存在,
的形式存在, +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。iii.碘单质能与I-反应:I2+I-

 (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。I制备消毒液(夹持装置略)

(1)制备NaClO的离子反应方程式
(2)结合资料i,写出D中反应的化学方程式
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9gKI固体 | |溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9gKI固体,再加入1mol/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
假设1:过量的NaClO将反应生成的I2氧化为
 。
。设计实验a证实了假设1成立。NaClO氧化I2生成
 的离子方程式是
的离子方程式是假设2:生成的I2在碱性溶液中不能存在。
设计实验b证实了假设2成立,实验b的操作及现象是
(4)某小组检验烧杯3所得溶液中含
 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
您最近一年使用:0次
2022-05-31更新
|
508次组卷
|
3卷引用:北京市第一六六中学2022届高三下学期三模化学试题
名校
6 . 火法有色金属冶炼烟气制酸过程中会产生大量含砷污酸,采用硫化-石膏中和法处理含砷污酸可获得达标废水,同时实现变废为宝得到多级产品,工艺流程如下:
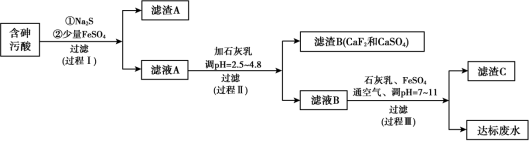
资料:
ⅰ. 常温下H2CO3的Ka1 = 4.4×10-7 ,Ka2 = 4.7×10-11;H2S的Ka1 = 1.3×10-7 ,Ka2 = 7.1×10-15;
ⅱ. 含砷污酸中砷的主要存在形式为亚砷酸(H3AsO3,弱酸),除砷外H+、Cu2+、F-、SO 含量均超标;
含量均超标;
ⅲ.室温下三价砷在水溶液中的存在形式与溶液pH的关系:
(1)工业上制备Na2S时,用NaOH溶液吸收H2S,不能以纯碱代替NaOH。结合方程式解释不能使用纯碱的原因___________ 。
(2)过程Ⅰ可除去含砷污酸中的Cu2+和部分砷,滤渣A 的主要成分为CuS和As2S3,生成As2S3的离子方程式是___________ 。
(3)过程Ⅰ会发生副反应As2S3(s)+3S2-(aq) 2AsS
2AsS (aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因
(aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因___________ 。
(4)过程Ⅲ中获得的滤渣C主要成分是FeAsO4, 该过程通入空气的作用是___________ 。
(5)利用反应AsO +2I-+2H+ =AsO
+2I-+2H+ =AsO +I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到
+I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到___________ 现象说明已到滴定终点,重复三次实验,记录用去Na2S2O3溶液体积为V mL,计算样品纯度为 ___________ (用字母表示)。
资料:2Na2S2O3+I2=Na2S4O6+2NaI;FeAsO4相对分子质量为195

资料:
ⅰ. 常温下H2CO3的Ka1 = 4.4×10-7 ,Ka2 = 4.7×10-11;H2S的Ka1 = 1.3×10-7 ,Ka2 = 7.1×10-15;
ⅱ. 含砷污酸中砷的主要存在形式为亚砷酸(H3AsO3,弱酸),除砷外H+、Cu2+、F-、SO
 含量均超标;
含量均超标;ⅲ.室温下三价砷在水溶液中的存在形式与溶液pH的关系:
| pH值 | pH<7 | pH=10~11 |
| 主要存在形式 | H3AsO3 | H2AsO |
(2)过程Ⅰ可除去含砷污酸中的Cu2+和部分砷,滤渣A 的主要成分为CuS和As2S3,生成As2S3的离子方程式是
(3)过程Ⅰ会发生副反应As2S3(s)+3S2-(aq)
 2AsS
2AsS (aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因
(aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因(4)过程Ⅲ中获得的滤渣C主要成分是FeAsO4, 该过程通入空气的作用是
(5)利用反应AsO
 +2I-+2H+ =AsO
+2I-+2H+ =AsO +I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到
+I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到资料:2Na2S2O3+I2=Na2S4O6+2NaI;FeAsO4相对分子质量为195
您最近一年使用:0次
2022-04-16更新
|
517次组卷
|
3卷引用:北京市顺义区2021-2022学年高三下学期4月第二次统练化学试题
北京市顺义区2021-2022学年高三下学期4月第二次统练化学试题北京市第十二中学2022-2023学年高二下学期3月练习化学试题(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)
名校
7 . 常温下,向20mL0.2mol/LH2X溶液中滴加0.2mol/LNaOH溶液,溶液中各微粒的物质的量分数随pH的变化如图所示,以下说法不正确的是


| A.由图可推测,H2X为弱酸 |
| B.滴加过程中发生的反应有:H2X+OH-=HX-+H2O,HX-+OH-=X2-+H2O |
| C.水的电离程度:a点与b点大致相等 |
| D.若常温下Ka(HY)=1.1×10-2,HY与少量Na2X发生的反应是:2HY+X2-=H2X+2Y- |
您最近一年使用:0次
2022-05-06更新
|
815次组卷
|
11卷引用:北京市昌平区2022届高三二模化学试题
北京市昌平区2022届高三二模化学试题北京市育才学校2022届高三下学期三模化学试题(已下线)专题13 水溶液中的离子平衡-备战2023年高考化学母题题源解密(全国通用)湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题黑龙江省哈尔滨市实验中学2022-2023学年高三上学期期中考试化学试题山东省青岛市莱西市2022-2023学年高二上学期12月期末考试化学试题黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期期末考试化学试卷天津市重点校2023-2024学年高二上学期期末考试化学试题湖北省沙市中学2023-2024学年高二上学期1月期末化学试题黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学验收考试化学黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学化学试题
21-22高三上·浙江杭州·阶段练习
名校
8 . 下列说法正确 的是
| A.测得0.1mol·L-1的一元碱ROH溶液pH=12,则ROH一定为弱电解质 |
| B.25℃时,可溶性正盐BA溶液pH=a,升温至某一温度后pH仍为a,则BA可能为强碱弱酸盐 |
| C.25℃时,测得0.1mol·L-1的一元酸HA溶液pH=b,将该溶液加水稀释100倍,所得溶液的pH=b+2,则HA为弱酸 |
| D.25℃时,pH=1的HA溶液与pH=13的NaOH溶液等体积混合,所得溶液pH一定等于7.0 |
您最近一年使用:0次
2022-01-03更新
|
716次组卷
|
6卷引用:一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)微专题37 强弱电解质的判断与比较-备战2023年高考化学一轮复习考点微专题浙江省宁波市北仑中学2023-2024学年高二上学期期中考试化学试题
9 . 常温下,某弱酸HA溶液中主要成分的物质的量浓度分数随pH的变化如图所示。下列有关叙述不正确的是


A.常温下,HA的电离平衡常数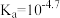 | B.若温度升高,曲线交点M会向左移动 |
C.NaA的水解平衡常数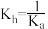 | D.某 的缓冲溶液,pH约为4 的缓冲溶液,pH约为4 |
您最近一年使用:0次
名校
10 . 电离平衡常数有重要的功能,下列推测不合理的是
| 化学式 | H2CO3 | HCN | HF |
| 电离平衡常数(K) | Ka1=4.5×10-7 Ka2=4.7×10-11 | 6.2×10-10 | 6.8×10-4 |
A.电离出H+的能力:HF>H2CO3>HCN> |
| B.相同物质的量浓度溶液的pH:NaF<NaHCO3<NaCN |
| C.HCN和HF均能与Na2CO3溶液发生反应 |
D.CO2通入NaCN溶液中:CO2+2CN-+H2O=2HCN+ |
您最近一年使用:0次
2022-04-29更新
|
478次组卷
|
6卷引用:北京市丰台区2022届高三二模化学试题



