名校
1 . 常温下,用0.1 mol⋅L 的NaOH溶液滴定10.00 mL 0.1 mol⋅L
的NaOH溶液滴定10.00 mL 0.1 mol⋅L 二元酸
二元酸 ,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是
,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是 的电离常数
的电离常数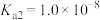 ;忽略混合时溶液体积变化。
;忽略混合时溶液体积变化。
 的NaOH溶液滴定10.00 mL 0.1 mol⋅L
的NaOH溶液滴定10.00 mL 0.1 mol⋅L 二元酸
二元酸 ,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是
,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是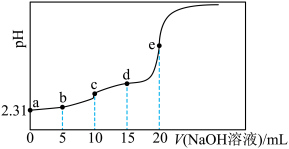
 的电离常数
的电离常数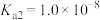 ;忽略混合时溶液体积变化。
;忽略混合时溶液体积变化。A. 的电离常数 的电离常数 约为 约为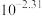 |
| B.e点溶液能使pH试纸变红 |
| C.c点水的电离程度比b点水的电离程度大 |
D.d点溶液中存在: mol⋅L mol⋅L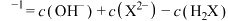 |
您最近一年使用:0次
2024-05-07更新
|
83次组卷
|
2卷引用:2024届海南省琼海市嘉积中学高三下学期模拟预测化学试题
名校
解题方法
2 . 常温下,亚砷酸 及其钠盐水溶液中的
及其钠盐水溶液中的 种
种 四种含砷微粒的分布系数(分布系数
四种含砷微粒的分布系数(分布系数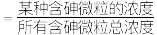 )与
)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 及其钠盐水溶液中的
及其钠盐水溶液中的 种
种 四种含砷微粒的分布系数(分布系数
四种含砷微粒的分布系数(分布系数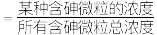 )与
)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是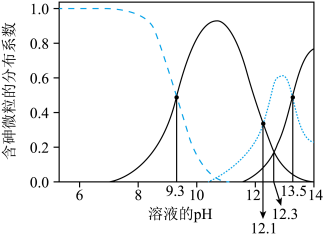
A.当 时,主要含砷微粒为 时,主要含砷微粒为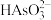 |
B.在水中 的 的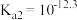 |
C. 的 的 与 与 的 的 等体积混合后,得到的溶液呈碱性 等体积混合后,得到的溶液呈碱性 |
D. 与 与 反应至 反应至 时, 时,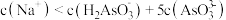 |
您最近一年使用:0次
3 . 联氨(N2H4)属于二元弱碱,在水溶液中的电离方程式为 、
、 。常温下,向含有一定量N2H6Cl2的溶液中加入NaOH,溶液中含氮微粒(
。常温下,向含有一定量N2H6Cl2的溶液中加入NaOH,溶液中含氮微粒( 、
、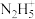 、
、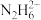 )的物质的量分数
)的物质的量分数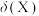 [如
[如 ]随pH变化的关系如图所示。下列叙述正确的是
]随pH变化的关系如图所示。下列叙述正确的是
 、
、 。常温下,向含有一定量N2H6Cl2的溶液中加入NaOH,溶液中含氮微粒(
。常温下,向含有一定量N2H6Cl2的溶液中加入NaOH,溶液中含氮微粒( 、
、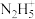 、
、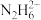 )的物质的量分数
)的物质的量分数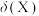 [如
[如 ]随pH变化的关系如图所示。下列叙述正确的是
]随pH变化的关系如图所示。下列叙述正确的是 
A.曲线Ⅲ代表 随溶液pH变化的关系 随溶液pH变化的关系 |
B.常温下, |
C.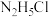 溶液中存在 溶液中存在 |
D.b点溶液中: |
您最近一年使用:0次
名校
4 . 碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
 [已知
[已知 ,
, ,
, 的电离常数
的电离常数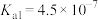 ,
, ,下列有关说法
,下列有关说法错误 的是

 [已知
[已知 ,
, ,
, 的电离常数
的电离常数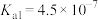 ,
, ,下列有关说法
,下列有关说法A.上层清液中存在 |
B.上层清液中含碳微粒最主要以 形式存在 形式存在 |
C.向体系中通入 气体,溶液中 气体,溶液中 增大 增大 |
D.通过加 溶液可实现 溶液可实现 向 向 的有效转化 的有效转化 |
您最近一年使用:0次
名校
5 . 某实验小组测得:在相同温度和压强下,氯气的饱和浓度c(Cl2)与盐酸的浓度关系如图所示。

已知:氯气溶解过程中发生如下反应:
①Cl2(aq)+H2O(l) H+(aq)+Cl-(aq)+HClO(aq) K1=4.2×10-4
H+(aq)+Cl-(aq)+HClO(aq) K1=4.2×10-4
②Cl2(aq)+Cl-(aq) C
C K2=0.19
K2=0.19
③HClO(aq) H+(aq)+ClO-(aq) K3=3.2×10-8
H+(aq)+ClO-(aq) K3=3.2×10-8
a点溶液中粒子浓度关系错误 的是

已知:氯气溶解过程中发生如下反应:
①Cl2(aq)+H2O(l)
 H+(aq)+Cl-(aq)+HClO(aq) K1=4.2×10-4
H+(aq)+Cl-(aq)+HClO(aq) K1=4.2×10-4②Cl2(aq)+Cl-(aq)
 C
C K2=0.19
K2=0.19③HClO(aq)
 H+(aq)+ClO-(aq) K3=3.2×10-8
H+(aq)+ClO-(aq) K3=3.2×10-8a点溶液中粒子浓度关系
| A.c(H+)>c(OH-) | B.c(Cl-)>c(C ) ) |
| C.c(Cl-)>c(ClO-) | D.c(ClO-)>c(C ) ) |
您最近一年使用:0次
名校
6 . 常温下,向 溶液(此时为a点)中不断加入
溶液(此时为a点)中不断加入 固体,溶液中由水电离出来的
固体,溶液中由水电离出来的 的负对数
的负对数 与
与 的变化关系如图所示。下列说法
的变化关系如图所示。下列说法错误 的是

 溶液(此时为a点)中不断加入
溶液(此时为a点)中不断加入 固体,溶液中由水电离出来的
固体,溶液中由水电离出来的 的负对数
的负对数 与
与 的变化关系如图所示。下列说法
的变化关系如图所示。下列说法
A. 的电离常数 的电离常数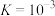 |
B.b点对应溶液中: |
C.c点对应溶液中: |
D.水的电离程度: |
您最近一年使用:0次
解题方法
7 . CO和NO是汽车尾气中的主要污染物,易引起酸雨、温室效应和光化学烟雾等环境污染问题。随着我国机动车保有量的飞速发展,汽车尾气的有效处理变得迫在眉睫。其中的一种方法为2CO(g)+2NO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知该反应为自发反应,则该反应的反应热△H___________ 0(填“>”或“<”或“=”)
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJ•mol -1
C(s) + O2 (g)=CO2 (g) △H= b kJ•mol -1
2C(s) + O2 (g)=2CO(g) △H= c kJ•mol -1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=___________ kJ•mol-1 (用含 a、b、c 的表达式表示)。
(3)一定温度下,将 2molCO、4molNO 充入一恒压密闭容器。已知起始压强为 1MPa,到达平衡时, 测得N2的物质的量为 0.5 mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=___________ (写出计算表示式)
②该条件下,可判断此反应到达平衡的标志是___________
A.单位时间内,断裂 2 molC=O 同时形成 1 mol N≡N。
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:
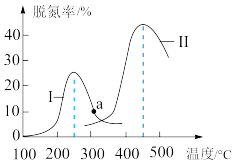
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为___________
②若低于 200℃,图中曲线 I 脱氮率随温度升高变化不大的主要原因为___________
(5)已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=___________ mol/L,将脱氮反应后生成CO2通入氨水中使溶液恰好呈中性,则此时 =
=___________ (保留小数点后4位数字)
(6)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质A,A是___________ ,理由是___________

(1)已知该反应为自发反应,则该反应的反应热△H
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJ•mol -1
C(s) + O2 (g)=CO2 (g) △H= b kJ•mol -1
2C(s) + O2 (g)=2CO(g) △H= c kJ•mol -1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=
(3)一定温度下,将 2molCO、4molNO 充入一恒压密闭容器。已知起始压强为 1MPa,到达平衡时, 测得N2的物质的量为 0.5 mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=
②该条件下,可判断此反应到达平衡的标志是
A.单位时间内,断裂 2 molC=O 同时形成 1 mol N≡N。
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:

①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为
②若低于 200℃,图中曲线 I 脱氮率随温度升高变化不大的主要原因为
(5)已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=
 =
=(6)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质A,A是

您最近一年使用:0次
2021-05-24更新
|
814次组卷
|
3卷引用:2021年海南高考化学试题变式题11-19
8 . 已知H3PO4是一种三元中强酸。25℃时,向某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如图所示。下列说法正确的是
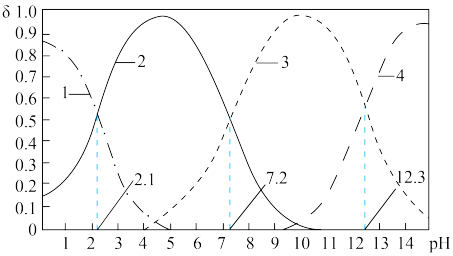

A.曲线2表示 ,曲线4表示 ,曲线4表示 |
B.25℃时,H3PO4的电离常数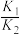 =105.1 =105.1 |
| C.pH=7.2时,溶液中由水电离出的c(H+)=10-6.8mol∙L-1 |
D.pH=12.3时,溶液中5c(Na+)=2c(H3PO4)+2c( )+2c( )+2c( )+2c( )+2c( ) ) |
您最近一年使用:0次
2021-03-09更新
|
886次组卷
|
4卷引用:2021年海南高考化学试题变式题11-19
2021年海南高考化学试题变式题11-19山东省济南市2020-2021学年高三下学期3月联考化学试题(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
解题方法
9 . 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。当向其中加入少量酸或碱时,溶液的酸碱性变化不大。回答下列问题:
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为______ ;另一份加入少量KOH溶液时,发生反应的离子方程式为______ 。
(2)现将0.04mol•L-1HA溶液和0.02mol•L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)______ c(CN-)。(填“<”“=”或“>”);
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是______ 。
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c( )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______ mol/L。
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为
(2)现将0.04mol•L-1HA溶液和0.02mol•L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c(
 )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=
您最近一年使用:0次
解题方法
10 . 碳酸和一水合氨是重要的弱酸和弱碱,常温下,其电离常数如下表所示。回答下列问题:
(1)碳酸的一级电离方程式为______ ,二级电离常数表达式
________ 。
(2)浓度均为0.01 mol.L-1的H2CO3溶液和NH3·H2O溶液等体积混合,混合溶液中的溶质是_______ (写化学式),混合溶液中 、
、 、
、 、
、 的浓度由大到小的顺序是
的浓度由大到小的顺序是_______ 。
(3) 和
和 在水溶液中相互促进水解,反应为
在水溶液中相互促进水解,反应为 ,则常温下,该反应的平衡常数
,则常温下,该反应的平衡常数
_______ 。(保留2位有效数字)。
(4)室温下,向100 mL 0.2 mol.L-1NaHCO3溶液中加入100 mL 0.2 mol·L-1NH3·H2O溶液,则 +
+____ +_____ 。
| 弱电解质 | H2CO3 | NH3·H2O | |
| 电离常数 |  | 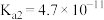 | 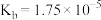 |

(2)浓度均为0.01 mol.L-1的H2CO3溶液和NH3·H2O溶液等体积混合,混合溶液中的溶质是
 、
、 、
、 、
、 的浓度由大到小的顺序是
的浓度由大到小的顺序是(3)
 和
和 在水溶液中相互促进水解,反应为
在水溶液中相互促进水解,反应为 ,则常温下,该反应的平衡常数
,则常温下,该反应的平衡常数
(4)室温下,向100 mL 0.2 mol.L-1NaHCO3溶液中加入100 mL 0.2 mol·L-1NH3·H2O溶液,则
 +
+
您最近一年使用:0次



