1 . 常温下,分别向MnCl2、ZnCl2、CH3COOH溶液中滴加NaOH溶液,溶液pX[pX=-lgc(X),X代表Mn2+、Zn2+、OH-,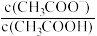 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
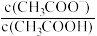 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是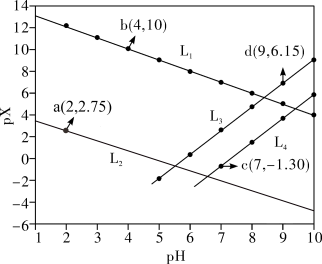
A.图中L2代表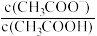 ,L3代表Mn2+ ,L3代表Mn2+ |
| B.室温下,Ksp[Zn(OH)2]的数量级为10-13 |
C.同时产生两种沉淀时,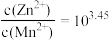 |
D.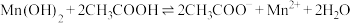 的平衡常数K=105.8 的平衡常数K=105.8 |
您最近一年使用:0次
2024-06-02更新
|
109次组卷
|
4卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
名校
解题方法
2 . 常温下,将 溶液滴入三元酸
溶液滴入三元酸 溶液中,混合溶液中
溶液中,混合溶液中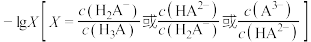 随
随 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是
 溶液滴入三元酸
溶液滴入三元酸 溶液中,混合溶液中
溶液中,混合溶液中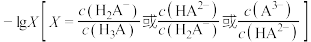 随
随 的变化关系如图所示。下列说法正确的是
的变化关系如图所示。下列说法正确的是
A.曲线 表示 表示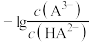 随 随 的变化关系 的变化关系 |
B.当 时,混合溶液中 时,混合溶液中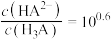 |
C.常温下,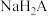 溶液中: 溶液中: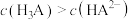 |
D.当 时, 时, |
您最近一年使用:0次
2024-04-21更新
|
343次组卷
|
5卷引用:广西南宁市2024届高三下学期二模考试化学试题
3 . 滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。25℃时,用0.01000mol•L-1NaOH溶液滴定0.1000mol•L-1H2C2O4溶液所得滴定曲线如图所示。已知10-1.3=0.05,下列说法正确的是
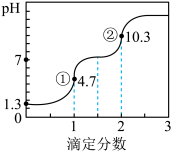

| A.从①点到②点水的电离程度逐渐增大 |
B.点②所示溶液中:c(Na+)+c(H+)=c(HC2O )+c(C2O )+c(C2O )+c(OH-) )+c(OH-) |
C.点①所示溶液中:c(Na+)>c(HC2O )>c(H2C2O4)>c(C2O )>c(H2C2O4)>c(C2O ) ) |
| D.25℃时H2C2O4的电离常数:Ka1=10-1.6 |
您最近一年使用:0次
2023-10-27更新
|
898次组卷
|
2卷引用:广西部分高中2024届高三第一次摸底测试化学试题
4 . 常温下,用0.2 mol·L-1NaOH溶液滴定20.00mL一定浓度的一元酸HR溶液时,混合溶液的pH变化情况如图所示,图中a点为滴定终点。下列有关说法正确的是


| A.图中x=7 |
| B.常温下,HR的电离常数Ka=5.0×10-5 |
| C.a点溶液中: c(R-)+ c(OH-)- c(H+)=0.1 mol·L-1 |
| D.b点溶液中: c(Na+)> c(R-)> c(OH-)> c(H+) |
您最近一年使用:0次
解题方法
5 . 25°C时 ,在锥形瓶中加入25.00mL 0.1000mol·L-1H2C2O4溶液,加入指示剂,然后用0.1000mol·L‑1NaOH 溶液滴定,得到如图所示溶液的pH随滴加NaOH溶液的体积的变化曲线。下列说法正确的是(已知:10-1.3=0.05)


| A.滴定前,锥形瓶要用0.1000mol·L-1H2C2O4溶液润洗 |
| B.Ka1(H2C2O4)= 10-1.6 |
C.图中c点溶液离子浓度大小为: c(Na+ )>c( )>c( )>c( )>c(H2C2O4) )>c(H2C2O4) |
D.a点溶液中: c(OH -)+c( )=c(H2C2O4)+c(H+) )=c(H2C2O4)+c(H+) |
您最近一年使用:0次
2022-05-30更新
|
1149次组卷
|
2卷引用:广西桂林、崇左、贺州、河池、来宾市2022届高三下学期4月联合模拟考试理科综合化学试题
6 . 常温下,将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
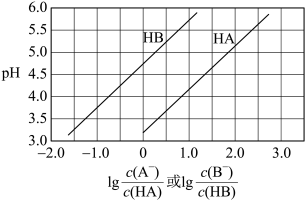

| A.Ka(HA)的数量级为10−5 |
| B.当NaOH溶液与HB混合至中性时:c(B−)<c(HB) |
| C.等浓度的NaA、NaB溶液中,水的电离程度:NaA>NaB |
| D.等浓度的HB和NaA的混合溶液中:c(Na+)>c(A−)>c(B−)>c(H+)>c(OH−) |
您最近一年使用:0次
7 . 草酸化学式为H2C2O4。25℃时,H2C2O4的电离平衡常数K1=5.0×10-2,K2=5.4×10-5。25℃时,用0.2mol/L的NaOH溶液滴定25mL0.2mol/L的H2C2O4溶液的滴定曲线如图所示。下列说法正确的是


A.Y点溶液c(H+)>c(H2C2O4)>c( ) ) |
B.0.1mol/LNaHC2O4,溶液中c(H+)+c(H2C2O4)=2c( )+c(OH-) )+c(OH-) |
| C.X点溶液的pH约为2 |
D.Z点溶液的 |
您最近一年使用:0次
名校
解题方法
8 . 某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L 0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的 物质的量分数与溶液pH的关系如图乙所示,(已知HA=H++HA- HA-  H++A2-)则下列说法中正确的是
H++A2-)则下列说法中正确的是


 H++A2-)则下列说法中正确的是
H++A2-)则下列说法中正确的是

| A.pH=3.0时,可以计算出Ka2= 10 -3 |
| B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
| C.该实验左边的滴定管为碱式滴定管,用来盛装NaOH溶液,烧杯中并加酚酞作指示剂 |
| D.常温下,将等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 |
您最近一年使用:0次
2020-07-03更新
|
206次组卷
|
2卷引用:广西桂林市第十八中学2020届高三考前适应性考试化学试题
解题方法
9 . 机动车尾气和燃煤产生的烟气是目前城市空气污染的重要原因之一。NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) ∆H=-akJ·mol-1
2CO2(g)+N2(g) ∆H=-akJ·mol-1
(1)CO可用于炼铁,已知:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H=+489.0kJ/mol
②C(s)+CO2(g)=2CO(g)△H=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为_____________________
(2)在一定温度下,将1.2 mol NO、1.0 mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

0~20 min CO2的平均速率v(CO2)=____________ ,CO的转化率为____________
(3)下列能够说明该反应已经达到平衡的是__________
a.该容器内压强不再改变
b.上述反应的焓变∆H不变
c. v(NO)=2v(N2)
d.混合气体的密度不再变化
(4)若保持反应体系的温度不变,20 min时再向容器中充CO、CO2各0.2mol,化学平衡将__________ (填“逆向”“正向”或“不”)移动。重新达到平衡后,该反应的化学平衡常数为__________ (结果保留两位有效数字)
(5)利用反应2NO2+4CO=N2+4CO2可以处理汽车尾气。若将该反应设计为原电池,用熔融NaCO3作电解质,其正极电极反应式为_____________
(6)工业上用氨水将SO2转化为(NH4)2SO3,再氧化为(NH4)2SO4。已知25℃时,0.05mol/L(NH4)2SO4溶液的pH=a,则c(NH4+):c(NH3·H2O)=__________ 用含a的代数式表示,已知NH3·H2O的电离常数为Kb=1.7×10-5)。
 2CO2(g)+N2(g) ∆H=-akJ·mol-1
2CO2(g)+N2(g) ∆H=-akJ·mol-1(1)CO可用于炼铁,已知:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H=+489.0kJ/mol
②C(s)+CO2(g)=2CO(g)△H=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为
(2)在一定温度下,将1.2 mol NO、1.0 mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

0~20 min CO2的平均速率v(CO2)=
(3)下列能够说明该反应已经达到平衡的是
a.该容器内压强不再改变
b.上述反应的焓变∆H不变
c. v(NO)=2v(N2)
d.混合气体的密度不再变化
(4)若保持反应体系的温度不变,20 min时再向容器中充CO、CO2各0.2mol,化学平衡将
(5)利用反应2NO2+4CO=N2+4CO2可以处理汽车尾气。若将该反应设计为原电池,用熔融NaCO3作电解质,其正极电极反应式为
(6)工业上用氨水将SO2转化为(NH4)2SO3,再氧化为(NH4)2SO4。已知25℃时,0.05mol/L(NH4)2SO4溶液的pH=a,则c(NH4+):c(NH3·H2O)=
您最近一年使用:0次
名校
10 . 常温下,向10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH•H2O]的混合溶液中逐滴加入盐酸。利用传感器测得该过程溶液中的阳离子总浓度变化曲线如图;已知二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O]=l.60×l0-4。下列说法正确的是( )


| A.a点溶液中,c[(CH3)2NH2+]约为l.60×l0-4mol/L |
| B.从a到c的过程中,水的电离程度最大的是b点 |
| C.c点溶液中:3c(Na+)+c[(CH3)2NH2+]=2c(Cl-) |
| D.V(HCl)=15.00mL时,c[(CH3)2NH2+]<c[(CH3)2NH•H2O] |
您最近一年使用:0次
2020-06-05更新
|
1418次组卷
|
3卷引用:广西南宁市2020届高三第二次适应性测试理科综合化学试题



