1 . 侯氏制碱法是我国化学工程专家侯德榜于1943年创立的,是生产纯碱和氯化铵两种产品的方法。其原理为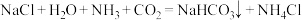 ,
,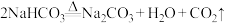 ,下列说法正确的是
,下列说法正确的是
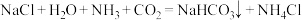 ,
,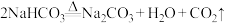 ,下列说法正确的是
,下列说法正确的是A.氨水加水稀释过程中, 逐渐减小 逐渐减小 |
B.NH4Cl溶液中存在: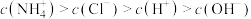 |
| C.等物质的量浓度的NaHCO3溶液和Na2CO3溶液中水的电离程度:前者大于后者 |
D.0.1mol·L-1NaHCO3溶液中: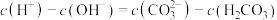 |
您最近一年使用:0次
名校
解题方法
2 .  与
与 同为第
同为第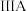 族元素,溶液中
族元素,溶液中 及其与
及其与 形成的微粒的浓度分数
形成的微粒的浓度分数 随溶液
随溶液 变化的关系如图所示。已知
变化的关系如图所示。已知 的
的 溶液的
溶液的 约为3.4,常温下,向
约为3.4,常温下,向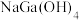 溶液中滴加醋酸溶液,关于该过程的说法正确的是
溶液中滴加醋酸溶液,关于该过程的说法正确的是
 与
与 同为第
同为第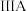 族元素,溶液中
族元素,溶液中 及其与
及其与 形成的微粒的浓度分数
形成的微粒的浓度分数 随溶液
随溶液 变化的关系如图所示。已知
变化的关系如图所示。已知 的
的 溶液的
溶液的 约为3.4,常温下,向
约为3.4,常温下,向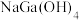 溶液中滴加醋酸溶液,关于该过程的说法正确的是
溶液中滴加醋酸溶液,关于该过程的说法正确的是
A.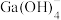 的浓度分数一直不变 的浓度分数一直不变 |
B.反应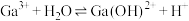 的平衡常数 的平衡常数 的数量级为 的数量级为 |
C. 时, 时, |
D.当溶液中 与 与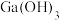 的浓度相等时, 的浓度相等时, |
您最近一年使用:0次
2024-06-02更新
|
263次组卷
|
3卷引用:广东省华南师范大学附属中学2024届高三下学期高考适应性练习(4月)化学试题
3 . 常温下,等浓度的氨水和醋酸溶液互相滴定过程中,溶液中pH与pX[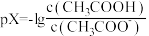 或
或 ]的关系如图所示。下列说法错误的是
]的关系如图所示。下列说法错误的是
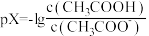 或
或 ]的关系如图所示。下列说法错误的是
]的关系如图所示。下列说法错误的是
A.常温下, |
B.水的电离程度: |
| C.曲线Ⅱ代表NH3•H2O溶液滴定CH3COOH溶液 |
D.g点 |
您最近一年使用:0次
2024-04-11更新
|
448次组卷
|
6卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
4 . 常温下,用 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示。下列说法错误的是
氨水的滴定曲线如图所示。下列说法错误的是
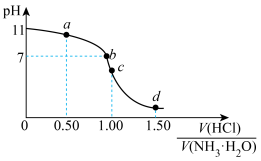
 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示。下列说法错误的是
氨水的滴定曲线如图所示。下列说法错误的是
A. 时, 时,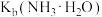 的数量级为 的数量级为 |
B. 点溶液中: 点溶液中: |
C.水的电离程度: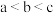 |
D. 点溶液中: 点溶液中: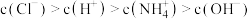 |
您最近一年使用:0次
2023-12-13更新
|
128次组卷
|
2卷引用:广东省深圳市富源学校2023-2024学年高二上学期模拟预测化学试题
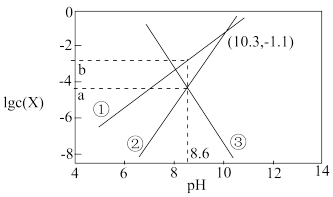
5 . 天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知Ksp(CaCO3)=10-8.7,某溶洞水体中lgc(X)(X为HCO 、CO
、CO 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是
 、CO
、CO 或Ca2+)与pH的关系如图所示。下列说法正确的是
或Ca2+)与pH的关系如图所示。下列说法正确的是
A.曲线②代表HCO |
| B.Ka2(H2CO3)的数量级为10-10 |
| C.a=-4.35,b=-2.75 |
| D.pH=10.3时,c(Ca2+)=10-7.6mol•L-1 |
您最近一年使用:0次
6 . 硫酸工业尾气(主要含SO2、N2和O2)用Na2SO3溶液吸收可转化为NaHSO3,下列说法不正确 的是
A.Na2SO3溶液中存在:c(OH-)=c(H+)+c(HSO )+2c(H2SO3) )+2c(H2SO3) |
B.Na2SO3溶液吸收SO2的离子方程式:SO +SO2+H2O=2HSO +SO2+H2O=2HSO |
C.Na2SO3溶液加水稀释,溶液中 的值逐渐变小 的值逐渐变小 |
| D.用pH试纸测得0.1mol•L-1的NaHSO3溶液的pH约为5,则Ka1(H2SO3)•Ka2(H2SO3)>Kw |
您最近一年使用:0次
名校
7 . 某温度下,向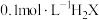 溶液中缓慢加入固体
溶液中缓慢加入固体 ,溶液
,溶液 、温度随
、温度随 被滴定分数的变化如图所示(忽略溶液体积变化)。下列说法
被滴定分数的变化如图所示(忽略溶液体积变化)。下列说法错误 的是

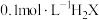 溶液中缓慢加入固体
溶液中缓慢加入固体 ,溶液
,溶液 、温度随
、温度随 被滴定分数的变化如图所示(忽略溶液体积变化)。下列说法
被滴定分数的变化如图所示(忽略溶液体积变化)。下列说法
A.M点的 小于 小于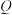 点的 点的 |
B.N点, |
| C.P点对应的溶液一定显中性 |
| D.M、N、P、Q四点中,水的电离程度最大的是Q点 |
您最近一年使用:0次
解题方法
8 . 盐与酸的反应是水溶液中常见的反应,某学习小组展开相关探究。
I.碳酸氢钠片抗酸容量(σ)的测定
(1)碳酸氢钠片能中和过多的胃酸(主要成分是HCl),小组同学测定其抗酸容量的实验步骤如下:
a.配制100mL0.2mol•L-1的盐酸溶液;
b.称取mg碳酸氢钠片,溶于20mL水中,用上述盐酸溶液滴定至pH=3。
已知:碳酸氢钠片的抗酸容量是指用盐酸溶液滴定碳酸氢钠片水溶液至pH=3时,单位质量的碳酸氢钠片所消耗的盐酸的物质的量,即σ= 。
。
①步骤a需4mol•L-1盐酸的体积为_____ mL(保留1位小数)。
②步骤b需要用到图中所示仪器中的_____ (填名称)。

③若步骤b中消耗盐酸的体积为VmL,则σ=______ mol•g-1。
II.Na2HPO4-KH2PO4混合溶液抗酸能力的探究
Na2HPO4-KH2PO4混合溶液具有抗酸能力。向该溶液中加入少量盐酸,溶液的pH变化不大;加入盐酸的量相等时,溶液的pH变化越小,溶液的抗酸能力越强。
已知:i.25℃时,H3PO4的Ka1=7.6×10-3,Ka2=6.3×10-8,Ka3=4.4×10-13,lg4.4=0.64,lg6.3=0.80,lg7.6=0.88;
ii.Na2HPO4-KH2PO4混合溶液的抗酸能力与[c(Na2HPO4)+c(KH2PO4)]、 有关。
有关。
(2)HPO 和H2PO
和H2PO 可发生相互转化,写出其中一种转化的离子方程式:
可发生相互转化,写出其中一种转化的离子方程式:______ 。
(3)小组同学设计实验探究 相同时,[c(Na2HPO4)+c(KH2PO4)]对混合溶液抗酸能力的影响,溶液配制方案如表。分别向溶液1、溶液2、溶液3中滴加0.1mol•L-1盐酸,溶液的pH随加入盐酸滴数的变化情况如图所示。
相同时,[c(Na2HPO4)+c(KH2PO4)]对混合溶液抗酸能力的影响,溶液配制方案如表。分别向溶液1、溶液2、溶液3中滴加0.1mol•L-1盐酸,溶液的pH随加入盐酸滴数的变化情况如图所示。

①已知A点时, =1,则此时溶液的pH=
=1,则此时溶液的pH=______ (精确至小数点后1位)。
②实验结果显示,NaCl溶液不具有抗酸能力,即曲线_____ (填曲线标号)表示溶液1。
③实验结果显示,当 相同时,[c(Na2HPO4)+c(KH2PO4)]越大,混合溶液的抗酸能力越强,则曲线b表示溶液
相同时,[c(Na2HPO4)+c(KH2PO4)]越大,混合溶液的抗酸能力越强,则曲线b表示溶液______ (填溶液序号)。
(4)小组同学继续探究[c(Na2HPO4)+c(KH2PO4)]相同时, 对混合溶液抗酸能力的影响,实验方案如表:
对混合溶液抗酸能力的影响,实验方案如表:
①表中x=_____ 。
②实验结果显示,当[c(Na2HPO4)+c(KH2PO4)]相同时, 越大,溶液的抗酸能力越强,能支撑该结论的实验结果是
越大,溶液的抗酸能力越强,能支撑该结论的实验结果是______ (用含A1、A2、A3、A4、A5、A6的关系式表示)。
I.碳酸氢钠片抗酸容量(σ)的测定
(1)碳酸氢钠片能中和过多的胃酸(主要成分是HCl),小组同学测定其抗酸容量的实验步骤如下:
a.配制100mL0.2mol•L-1的盐酸溶液;
b.称取mg碳酸氢钠片,溶于20mL水中,用上述盐酸溶液滴定至pH=3。
已知:碳酸氢钠片的抗酸容量是指用盐酸溶液滴定碳酸氢钠片水溶液至pH=3时,单位质量的碳酸氢钠片所消耗的盐酸的物质的量,即σ=
 。
。①步骤a需4mol•L-1盐酸的体积为
②步骤b需要用到图中所示仪器中的

③若步骤b中消耗盐酸的体积为VmL,则σ=
II.Na2HPO4-KH2PO4混合溶液抗酸能力的探究
Na2HPO4-KH2PO4混合溶液具有抗酸能力。向该溶液中加入少量盐酸,溶液的pH变化不大;加入盐酸的量相等时,溶液的pH变化越小,溶液的抗酸能力越强。
已知:i.25℃时,H3PO4的Ka1=7.6×10-3,Ka2=6.3×10-8,Ka3=4.4×10-13,lg4.4=0.64,lg6.3=0.80,lg7.6=0.88;
ii.Na2HPO4-KH2PO4混合溶液的抗酸能力与[c(Na2HPO4)+c(KH2PO4)]、
 有关。
有关。(2)HPO
 和H2PO
和H2PO 可发生相互转化,写出其中一种转化的离子方程式:
可发生相互转化,写出其中一种转化的离子方程式:(3)小组同学设计实验探究
 相同时,[c(Na2HPO4)+c(KH2PO4)]对混合溶液抗酸能力的影响,溶液配制方案如表。分别向溶液1、溶液2、溶液3中滴加0.1mol•L-1盐酸,溶液的pH随加入盐酸滴数的变化情况如图所示。
相同时,[c(Na2HPO4)+c(KH2PO4)]对混合溶液抗酸能力的影响,溶液配制方案如表。分别向溶液1、溶液2、溶液3中滴加0.1mol•L-1盐酸,溶液的pH随加入盐酸滴数的变化情况如图所示。
| 溶液序号 | 组成 | 体积/mL |
| 1 | 0.2mol•L-1NaCl溶液 | 10 |
| 2 | 0.2mol•L-1Na2HPO4溶液 | 5 |
| 0.2mol•L-1KH2PO4溶液 | 5 | |
| 3 | 0.06mol•L-1Na2HPO4溶液 | 5 |
| 0.06mol•L-1KH2PO4溶液 | 5 |
 =1,则此时溶液的pH=
=1,则此时溶液的pH=②实验结果显示,NaCl溶液不具有抗酸能力,即曲线
③实验结果显示,当
 相同时,[c(Na2HPO4)+c(KH2PO4)]越大,混合溶液的抗酸能力越强,则曲线b表示溶液
相同时,[c(Na2HPO4)+c(KH2PO4)]越大,混合溶液的抗酸能力越强,则曲线b表示溶液(4)小组同学继续探究[c(Na2HPO4)+c(KH2PO4)]相同时,
 对混合溶液抗酸能力的影响,实验方案如表:
对混合溶液抗酸能力的影响,实验方案如表:| 溶液序号 | 试剂体积/mL | pH | 加入24滴0.1mol•L-1盐酸后的pH | |
| 0.2mol•L-1Na2HPO4溶液 | xmol•L-1KH2PO4溶液 | |||
| 4 | 9 | 1 | A1 | A4 |
| 5 | 8 | 2 | A2 | A5 |
| 6 | 5 | 5 | A3 | A6 |
②实验结果显示,当[c(Na2HPO4)+c(KH2PO4)]相同时,
 越大,溶液的抗酸能力越强,能支撑该结论的实验结果是
越大,溶液的抗酸能力越强,能支撑该结论的实验结果是
您最近一年使用:0次
解题方法
9 . 室温下,以氟磷灰石 为原料,经酸浸、转化可得到
为原料,经酸浸、转化可得到 、
、 和
和 。已知:25℃,
。已知:25℃, 的
的 、
、 、
、 (
( );下列说法不正确的是
);下列说法不正确的是
 为原料,经酸浸、转化可得到
为原料,经酸浸、转化可得到 、
、 和
和 。已知:25℃,
。已知:25℃, 的
的 、
、 、
、 (
( );下列说法不正确的是
);下列说法不正确的是A.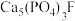 的沉淀溶解平衡可表示为: 的沉淀溶解平衡可表示为: |
B.酸浸过程中溶液 时, 时, |
C.  溶液中存在: 溶液中存在: |
D.向  溶液中加入少量水稀释时, 溶液中加入少量水稀释时, 的值增大 的值增大 |
您最近一年使用:0次
2023-04-22更新
|
1255次组卷
|
2卷引用:广东省深圳市2023届高三下学期第二次调研考试化学试题
名校
10 . 硫及其化合物在日常生活、工业生产中都非常普遍。
(1)SO2、H2S都是常见的污染性气体,具有一定的毒性。请再写出两种与酸雨、光化学烟雾和臭氧层空洞均有关的污染性气体:___________ 。
(2)变废为宝是治理污染的常用手段。以V2O5为催化剂,将SO2氧化为SO3,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
(i)SO2(g)+V2O5(s) SO3(g)+V2O4(s),活化能为Ea1。
SO3(g)+V2O4(s),活化能为Ea1。
(ii)2V2O4(s)+O2(g) 2V2O5(s),活化能为Ea2。
2V2O5(s),活化能为Ea2。
能量变化如图所示。

总反应2SO2(g)+O2(g) 2SO3(g)的
2SO3(g)的
___________ kJ∙mol−1 (用E1~E5中的合理数据组成的代数式表示)。决定SO2催化氧化的总反应速率的是步骤___________ (填(i)或(ii)),其活化能为___________ kJ∙mol−1 (用E1~E5中的合理数据组成的代数式表示)。
(3)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++ ,
,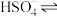 H++
H++ 。
。
①25℃时,Na2SO4溶液的pH___________ (填“>”“<”或“=”)7。
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数___________ (写出计算过程,结果保留三位有效数字)。
(4)液态水中,水存在自偶电离:H2O+H2O H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为___________ 。
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是___________ 。若保持温度不变,关于该所得溶液,下列说法正确的是___________ 。
A.加入少量冰醋酸,c( )与c(
)与c( )均减小
)均减小
B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c( )与c(
)与c( )的比值减小
)的比值减小
D.加入少量Na2SO4固体,c(Ac-)减小
(1)SO2、H2S都是常见的污染性气体,具有一定的毒性。请再写出两种与酸雨、光化学烟雾和臭氧层空洞均有关的污染性气体:
(2)变废为宝是治理污染的常用手段。以V2O5为催化剂,将SO2氧化为SO3,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
(i)SO2(g)+V2O5(s)
 SO3(g)+V2O4(s),活化能为Ea1。
SO3(g)+V2O4(s),活化能为Ea1。(ii)2V2O4(s)+O2(g)
 2V2O5(s),活化能为Ea2。
2V2O5(s),活化能为Ea2。能量变化如图所示。

总反应2SO2(g)+O2(g)
 2SO3(g)的
2SO3(g)的
(3)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++
 ,
,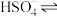 H++
H++ 。
。①25℃时,Na2SO4溶液的pH
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数
(4)液态水中,水存在自偶电离:H2O+H2O
 H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是
A.加入少量冰醋酸,c(
 )与c(
)与c( )均减小
)均减小B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c(
 )与c(
)与c( )的比值减小
)的比值减小D.加入少量Na2SO4固体,c(Ac-)减小
您最近一年使用:0次
2023-04-06更新
|
849次组卷
|
3卷引用:广东省汕头市金山中学2023届高三下学期一模化学试题



