1 . 常温下,向浓度均为 的两种钾盐
的两种钾盐 溶液中加水,溶液的
溶液中加水,溶液的 与稀释倍数
与稀释倍数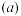 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
 的两种钾盐
的两种钾盐 溶液中加水,溶液的
溶液中加水,溶液的 与稀释倍数
与稀释倍数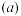 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是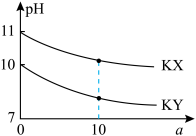
A.常温下, 的水解常数 的水解常数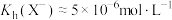 |
B.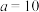 时, 时, 溶液中 溶液中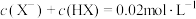 |
C.HY溶液可以与 溶液反应 溶液反应 |
D.浓度均为 的 的 和 和 溶液中离子总浓度: 溶液中离子总浓度: |
您最近一年使用:0次
2 . 室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、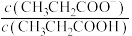 ]的关系如图所示。
]的关系如图所示。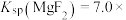
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
已知:
 、
、 、
、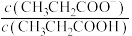 ]的关系如图所示。
]的关系如图所示。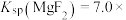
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的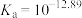 |
C.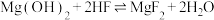 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近一年使用:0次
2024-04-01更新
|
563次组卷
|
6卷引用:2024届山西省太原市第五中学高三下学期一模理综试题-高中化学
2023高三·全国·专题练习
名校
3 . 已知K2Cr2O7溶液中存在平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+。分别在T1℃、T2℃恒温条件下,向100mL0.100mol·L-1的K2Cr2O7溶液中加入一定量K2Cr2O7固体,持续搅拌下用pH传感器连续测量溶液的pH,得到如图图象,下列说法正确的是
+2H+。分别在T1℃、T2℃恒温条件下,向100mL0.100mol·L-1的K2Cr2O7溶液中加入一定量K2Cr2O7固体,持续搅拌下用pH传感器连续测量溶液的pH,得到如图图象,下列说法正确的是
 +H2O
+H2O 2CrO
2CrO +2H+。分别在T1℃、T2℃恒温条件下,向100mL0.100mol·L-1的K2Cr2O7溶液中加入一定量K2Cr2O7固体,持续搅拌下用pH传感器连续测量溶液的pH,得到如图图象,下列说法正确的是
+2H+。分别在T1℃、T2℃恒温条件下,向100mL0.100mol·L-1的K2Cr2O7溶液中加入一定量K2Cr2O7固体,持续搅拌下用pH传感器连续测量溶液的pH,得到如图图象,下列说法正确的是
| A.图中T1℃>T2℃ |
B.t1后溶液中有2c(Cr2O )+c(CrO )+c(CrO )=c(K+) )=c(K+) |
| C.T2℃时,上述反应的平衡常数的数量级是10-12 |
D.T1℃下,加入一定量K2Cr2O7固体后达到新平衡时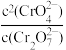 的值增大 的值增大 |
您最近一年使用:0次
2023-12-16更新
|
197次组卷
|
3卷引用:2024届山西省晋中市和诚高中高三下学期理综冲刺卷(二)-高中化学
解题方法
4 . 25℃时,用同一较高浓度的NaOH溶液分别滴定酸HA和CuSO4溶液,pM[p 表示负对数, M表示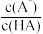 、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是
、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是

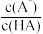 、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是
、c(Cu2+)]与溶液pH的变化关系如图。已知; CuA2 易溶于水,一般认为反应的平衡常数为K> 105时反应进行完全。下列说法错误的是
| A.HA为一元弱酸,25℃时 Ka=10-7.4 |
| B.①表示滴定CuSO4溶液时pM与溶液pH的关系 |
| C.滴定HA溶液至x点时,溶液中c(HA)> c(A-)> c(Na+) |
| D.滴定CuSO4溶液至x点时,若改为滴加HA溶液,沉淀会逐渐完全溶解 |
您最近一年使用:0次
5 . 常温下,用0.2mol·L-1NaOH溶液分别滴定相同浓度的一元酸HA溶液和HB溶液,溶液的pH随离子浓度的变化关系如图所示。已知电离常数Ka(HA) < Ka(HB),下列说法错误的是
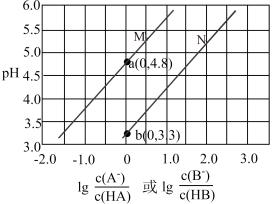

| A.曲线M代表HA溶液 |
| B.常温下,0.1 mol·L-1NaB溶液的pH约为8.15 |
| C.pH和体积均相同的两种酸溶液中水的电离程度:HA> HB |
D.将0.1 mol·L-1 HA溶液加水稀释10倍后,溶液中保持不变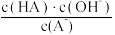 |
您最近一年使用:0次
2023-03-29更新
|
751次组卷
|
3卷引用:山西省太原市2023届高三一模理科综合化学试题
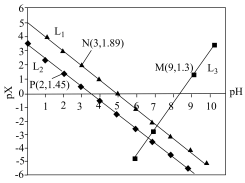
6 . 25°C时,在c(HR)+c(R-)=0.1mol·L-1的溶液中-lgc(R-)与-lgc(OH-)、难溶盐MR饱和溶液中-lgc(R-)与-lgc(M+)的关系如图所示(忽略离子浓度调节过程中溶液体积的变化)。下列说法错误的是
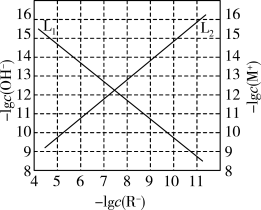

| A.曲线L2表示-lgc(R-)与-lgc(OH-)的关系 |
| B.25°C时,Ksp(MR)的数量级为10-20 |
| C.加水稀释,两种溶液中的离子浓度不一定都减小 |
| D.pH=7时,c(HR)+c(R-)=0.1mol·L-1的溶液中c(HR)<c(R-) |
您最近一年使用:0次
7 . 25℃时,体积均为V0mL、0.10mol·L-1NaX溶液和未知浓度的NaY溶液,分别加水稀释至VmL,溶液的pH与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.稀释前,c(NaX)=c(NaY) |
| B.电离常数:Ka(HX)<Ka(HY) |
C. 均等于2时,两溶液中c(X-)=c(Y-) 均等于2时,两溶液中c(X-)=c(Y-) |
| D.等浓度的NaX与HX的混合溶液中pH≈7 |
您最近一年使用:0次
8 . 常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的一元酸HX溶液和HY溶液(两溶液水的电离程度:HX>HY,当Ka≤10-5时可以认为电解质达到电离平衡时的浓度近似等于起始浓度),其滴定曲线如图所示
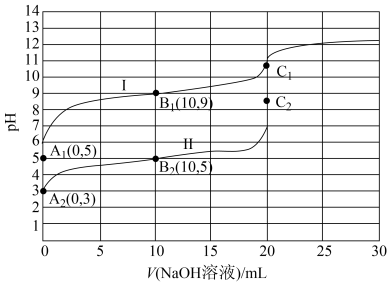
已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是

已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是
| A.曲线I和II对应的酸分别为HY和HX |
| B.相比曲线I,曲线II选用酚酞作终点指示剂误差更小 |
| C.把曲线上加入40mLNaOH溶液的点称为E点,则B1、C1和E三点溶液中由水电离出的c(H+)大小关系为C1>E>B1 |
| D.0.10mol/L弱酸HX和HY电离度之比为1:10 |
您最近一年使用:0次
9 . 25℃时,用HCl气体调节0.1 mol·L-1氨水的pH,体系中粒子浓度的对数值(lgc)、反应物的物质的量之比 与溶液pH的关系如图所示(忽略通入气体对溶液体积的影响)。下列有关说法错误的是
与溶液pH的关系如图所示(忽略通入气体对溶液体积的影响)。下列有关说法错误的是

 与溶液pH的关系如图所示(忽略通入气体对溶液体积的影响)。下列有关说法错误的是
与溶液pH的关系如图所示(忽略通入气体对溶液体积的影响)。下列有关说法错误的是
| A.25℃时,NH3·H2O的电离平衡常数为10-4. 75 |
B.t=0.5时,2c(OH-)+c(NH3·H2O) =c( )+2c(H+) )+2c(H+) |
| C.P1点所示溶液中c(Cl-) =0.05 mol·L-1 |
D.P2点所示溶液中c( )>100c(NH3·H2O) )>100c(NH3·H2O) |
您最近一年使用:0次
10 . 已知HA为一元弱酸,Ka为HA的电离常数,25℃时,某混合溶液中c(HA)+c(A-)=0.1 mol·L-1, lgc(HA)、lgc(A-)、lgc(H+)和lgc(OH-)随pH变化的关系如图所示。下列说法错误的是


| A.O点时,pH = 7 |
| B.Ka(HA)的数量级为10-5 |
| C.M点时,存在c(H+)=c(OH-)+C(A-) |
D.该体系中,c(HA)=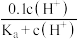 mol·L-1 mol·L-1 |
您最近一年使用:0次



