名校
解题方法
1 . 请根据有关知识,填写下列空白:
(1)一种难溶的废弃矿渣杂卤石,其主要成分可表示为K2SO4·MgSO4·2CaSO4·2H2O,已知它在水溶液中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s) 2K+(aq)+4
2K+(aq)+4 (aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。
(aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。
用化学平衡移动原理解释Ca(OH)2溶液能溶解出杂卤石中K+的原因:_____ 。
(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L−1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.8×10−10,忽略溶液的体积变化,请计算:完全沉淀后,溶液中c(Ag+)=_____ mol·L−1.
(3)N2H4是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。
写出N2H4(g)完全燃烧生成氮气和气态水热化学方程式_____ 。
(4)硫酸亚铁溶液常压蒸干得到的固体物质是_____ ,原因是_____ 。
(5)NH4Cl溶液可作焊接时的除锈剂,原因是_____ 。
(1)一种难溶的废弃矿渣杂卤石,其主要成分可表示为K2SO4·MgSO4·2CaSO4·2H2O,已知它在水溶液中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s)
 2K+(aq)+4
2K+(aq)+4 (aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。
(aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。用化学平衡移动原理解释Ca(OH)2溶液能溶解出杂卤石中K+的原因:
(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L−1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.8×10−10,忽略溶液的体积变化,请计算:完全沉淀后,溶液中c(Ag+)=
(3)N2H4是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。
写出N2H4(g)完全燃烧生成氮气和气态水热化学方程式
(4)硫酸亚铁溶液常压蒸干得到的固体物质是
(5)NH4Cl溶液可作焊接时的除锈剂,原因是
您最近一年使用:0次
名校
解题方法
2 . 25℃时,如果取0.1mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。回答以下问题:
(1)混合溶液的pH=8的原因:_______ (用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)_______ (填“>”“<”或“=”)0.1mol·L-1NaOH溶液中由水电离出的c(OH-)。
(3)混合溶液中c(OH-)-c(HA)=_______ mol·L-1。
(4)同温度下,等浓度的四种盐溶液中c(NH )由大到小的顺序是
)由大到小的顺序是_______ (填字母)。
A.NH4HSO4 B.NH4A C.(NH4)2SO4 D.NH4Cl
(1)混合溶液的pH=8的原因:
(2)混合溶液中由水电离出的c(OH-)
(3)混合溶液中c(OH-)-c(HA)=
(4)同温度下,等浓度的四种盐溶液中c(NH
 )由大到小的顺序是
)由大到小的顺序是A.NH4HSO4 B.NH4A C.(NH4)2SO4 D.NH4Cl
您最近一年使用:0次
2023-09-15更新
|
361次组卷
|
2卷引用:吉林省长春市第八中学2022-2023学年高二上学期11月期中考试化学试题
名校
3 . 常温下,用0.2000mol•L-1盐酸滴定25mL0.2000mol•L-1Na2CO3溶液(溶液均为新配制),其滴定曲线如图所示(已知:碳酸的电离常数Ka1=4×10-7,Ka2=5×10-11,忽略溶液混合时体积和温度的变化)。
回答下列问题:

(1)往0.1000mol•L-1Na2CO3溶液中滴入2~3滴无色酚酞,溶液颜色由无色变为_____ 色,判断的依据是_____ (用离子方程式表示),a点的pH为_____ 。
(2)b点混合溶液中主要的溶质有Na2CO3、NaCl和_____ (填化学式),此时 =
=_____ 。
(3)c点混合溶液中,c(Na+)、c(CO )、(HCO
)、(HCO )、c(OH-)、c(H+)由大到小的顺序为
)、c(OH-)、c(H+)由大到小的顺序为_____ 。
(4)d点混合溶液中,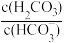 =
=_____ 。
回答下列问题:

(1)往0.1000mol•L-1Na2CO3溶液中滴入2~3滴无色酚酞,溶液颜色由无色变为
(2)b点混合溶液中主要的溶质有Na2CO3、NaCl和
 =
=(3)c点混合溶液中,c(Na+)、c(CO
 )、(HCO
)、(HCO )、c(OH-)、c(H+)由大到小的顺序为
)、c(OH-)、c(H+)由大到小的顺序为(4)d点混合溶液中,
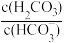 =
=
您最近一年使用:0次
名校
4 . 回答下列问题:
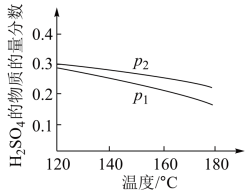
(1)对反应:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH2=−254kJ·mol−1,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2_____ p1(填“>”或“<”),得出该结论的理由是_____ 。
(2)已知:生物脱H2S的原理:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
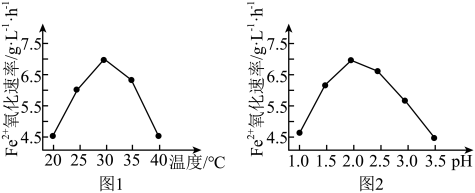
由图1和图2判断使用硫杆菌的最佳条件为_____ 。若反应温度过高,反应速率下降,其原因是_____ 。
(3)在常温下,某硫酸和硫酸铝两种溶液的pH都是3,那么硫酸中水电离出的c(H+)是硫酸铝溶液中水电离出的c(H+)的_____ 倍
(4)常温下pH=4的FeCl3溶液和pH=10的K2CO3溶液中,水的电离程度前者_____ 后者(填“大于”、“等于”、“小于”)。
(1)对反应:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH2=−254kJ·mol−1,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2


(2)已知:生物脱H2S的原理:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4
 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O由图1和图2判断使用硫杆菌的最佳条件为
(3)在常温下,某硫酸和硫酸铝两种溶液的pH都是3,那么硫酸中水电离出的c(H+)是硫酸铝溶液中水电离出的c(H+)的
(4)常温下pH=4的FeCl3溶液和pH=10的K2CO3溶液中,水的电离程度前者
您最近一年使用:0次
名校
5 . 常温下,下列各组离子在指定溶液中一定能大量共存的有几项
A.无色溶液中:K+、 、 、 、Al3+ 、Al3+ |
B.水电离出的c(H+)=1×10−13mol/L的溶液中: 、 、 、 、 、 、 |
C.无色溶液中:K+、 、 、 、 、 |
D.pH=10的溶液中: 、Na+、 、Na+、 、 、 |
您最近一年使用:0次
2023-08-28更新
|
164次组卷
|
3卷引用:吉林省长春市朝阳区长春外国语学校2022-2023学年高二上学期11月期中化学试题
名校
解题方法
6 . NaClO溶液具有漂白能力,已知25℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是
| A.0.01mol/LNaClO溶液中,c(ClO-)=0.01mol/L |
| B.长期露置在空气中,释放Cl2,漂白能力减弱 |
C.通入过量SO2,反应的离子方程式为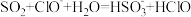 |
| D.25℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+) |
您最近一年使用:0次
2023-08-28更新
|
258次组卷
|
3卷引用:吉林省长春市朝阳区长春外国语学校2022-2023学年高二上学期11月期中化学试题
2009高二·湖南·学业考试
名校
解题方法
7 . 弱酸HA的溶液和等体积、等物质的量浓度的强碱MOH的溶液混合后,溶液中有关离子浓度的大小关系正确的是
| A.c(M+)>c(A-)>c(H+)>c(OH-) | B.c(A-)>c(M+)>c(OH-)>c(H+) |
| C.c(M+)>c(A-)>c(OH-)>c(H+) | D.c(M+)>c(OH-)>c(A-)>c(H+) |
您最近一年使用:0次
2023-02-11更新
|
364次组卷
|
55卷引用:吉林省长春市农安县2021-2022学年高二上学期期末考试化学试题
吉林省长春市农安县2021-2022学年高二上学期期末考试化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题吉林长春市榆树高级中学2019-2020学年高二下学期期末考试化学试题黑龙江省哈尔滨市第三十二中学校2021-2022学年高二下学期期中考试化学试题甘肃省武威市凉州区2021-2022学年高二上学期期末考试化学试题青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题云南省玉溪市通海县第三中学2021-2022学年高二上学期期末考试化学试题新疆疏勒县实验学校2021-2022学年高二上学期期末考试化学试题天津市东丽区2021-2022学年高二上学期期末考试化学试题吉林省辽源市等2地高中友好学校2022-2023学年高二上学期期末联考化学试题吉林省辽源、通化等2市2022-2023学年高二上学期1月期末考试化学试题(已下线)湖南师大附中高二化学选修4结业考试理科试题(已下线)09—10年泰州中学高二下学期期末考试化学卷(已下线)2010-2011学年湖北省武汉市三角路中学高二上学期期末考试化学试卷(已下线)2011-2012学年山西省大同市实验中学高二上学期期中考试化学试卷(已下线)2011-2012学年云南省会泽县第一中学高二6月月考化学试卷2014-2015宁夏回族自治区银川一中高二上学期期末考试化学试卷2015-2016学年贵州省凯里一中高二上学期期末化学试卷(已下线)2018年11月11日——《每日一题》 人教 必修4-每周一测河北省承德市第一中学2018-2019学年高二上学期第三次月考化学试题吉林省汪清县第六中学2019届高三上学期第二次月考化学试题海南省儋州市儋州一中2018-2019学年高二上学期期中考试化学试题【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期期末考试化学试题云南省峨山彝族自治县第一中学2018-2019学年高二6月月考化学试题广西南宁市“4N”高中联合体2018-2019学年高二下学期期末考试化学试题(已下线)2019年11月2日 《每日一题》选修4-周末培优(已下线)2019年11月10日 《每日一题》选修4——每周一测黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期中考试化学(理)试题贵州省金沙中学2019年普通高中学生学业基础水平测试化学试题河北省石家庄市元氏县第四中学2019-2020学年高二下学期期末考试化学试题辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期期中考试化学试题甘肃省兰州市第四片区2020-2021学年高二上学期期末考试化学试题湖南省长郡中学2020-2021学年高二上学期期中考试化学试题青海省西宁市海湖中学2020-2021学年高二下学期开学考试化学试题安徽省六安市新安中学2020-2021学年高二上学期期末考试(普通班)化学试题湖南省长沙市长郡中学2021-2022学年高二上学期期中考试化学试题浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题人教2019版选择性必修一第三章 第三节 盐类的水解 课后习题湘鄂冀三省益阳平高学校、长沙市平高中学等七校联考2021-2022学年高二上学期期中考试化学试题(已下线)专题20 用守恒思想破解溶液中粒子浓度大小的比较-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)宁夏青铜峡市高级中学2021-2022学年高二上学期11月测试化学试题甘肃省武威市凉州区2020-2021学年高二上学期期末考试化学试题天津市南开大学附属中学2022-2023学年高二上学期期末考试化学试卷山西省太原市2022-2023学年高二下学期2月期末考试化学试题青海省海南藏族自治州高级中学2022-2023学年高二下学期期末考试化学试题湖南省长沙市明德中学2023-2024学年高二上学期第一次月考化学试题北京市第八十中学2023-2024学年高二上学期期中考试化学试题【精品卷】3.3.1 盐类的水解课堂例题-人教版2023-2024学年选择性必修1(已下线)专题06 盐类的水解-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)福建省厦门市集美区2023-2024学年高二上学期12月月考化学试题湖南省张家界市民族中学2023-2024学年高二上学期期中考试化学试题四川省甘孜藏族自治州泸定中学2023-2024学年高二上学期11月期中考试化学试题(已下线)北京市石景山区2010学年第一学期期末考试试卷(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)
8 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1 mol/L NaOH溶液滴定10 mL 0.1 mol/L CH3COOH溶液的滴定曲线如图所示。
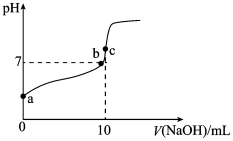
①a点溶液的pH_______ 1(填“>”、“<”或“=”,下同)。
②b点溶液中,c(Na+)_______ c(CH3COO-)。
③c点溶液中,c(Na+)_______ [c(CH3COO-)+c(CH3COOH)]。
④比较a、c两点水的电离程度:a_______ c。
(2)已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
①CH3COOH的电离平衡常数表达式Ka=_______ 。
②25 ℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)_______ pH(CH3COONa) (填“>”、“<”或“=”)。
③25℃时,用pH=2硫酸滴定pH=12 NaOH溶液时当二者体积相等混合液pH=_______ 。
④下列化学反应能发生的是_______ 。
A.HClO +CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2 +H2O+2NaClO=Na2CO3 +2HClO
(1)常温下,用0.1 mol/L NaOH溶液滴定10 mL 0.1 mol/L CH3COOH溶液的滴定曲线如图所示。

①a点溶液的pH
②b点溶液中,c(Na+)
③c点溶液中,c(Na+)
④比较a、c两点水的电离程度:a
(2)已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数(Ka) | 1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | 4.0×10-8 |
①CH3COOH的电离平衡常数表达式Ka=
②25 ℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:pH(NaClO)
③25℃时,用pH=2硫酸滴定pH=12 NaOH溶液时当二者体积相等混合液pH=
④下列化学反应能发生的是
A.HClO +CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2 +H2O+2NaClO=Na2CO3 +2HClO
您最近一年使用:0次
9 . 下列有关电解质溶液的说法不正确的是
| A.在pH=2的盐酸中由水电离出c(H+)和c(OH-)相等 |
| B.NaCl溶液和CH3COONH4溶液中水的电离程度相同 |
| C.pH =3的醋酸和盐酸加水稀释100倍后,pH(盐酸)>pH(醋酸) |
| D.CH3COONa和CH3COOH按物质的量1:1混合液中存在等式:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
您最近一年使用:0次
10 . 下列描述与盐类水解无关 的是
A.使用泡沫灭火器时将内筒与外筒的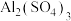 溶液和 溶液和 溶液倒立混合 溶液倒立混合 |
B.氮肥 与钾肥 与钾肥 混施可能会降低肥效 混施可能会降低肥效 |
| C.1 mol·L-1的醋酸加水稀释,溶液的pH增大,导电能力减弱 |
D.用 晶体配制溶液时,先将其溶于较浓盐酸中 晶体配制溶液时,先将其溶于较浓盐酸中 |
您最近一年使用:0次



