名校
解题方法
1 . 现有下列物质:①熔融的NaCl;②稀硫酸;③液氯;④冰醋酸;⑤铜;⑥BaSO4;⑦NaHSO4;⑧液氨;⑨SO2;⑩Cu(OH)2固体。请按要求回答下列问题。
(1)以上物质中属于弱电解质的是___________ (填序号,下同):属于非电解质的是___________ 。
(2)已知在t1、t2温度下水的电离平衡曲线如图所示:

①t1温度时,若盐酸中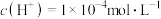 ,则由水电离产生的
,则由水电离产生的
___________  。
。
②t2温度下将pH=2的稀硫酸与pH=10的KOH溶液等体积混合后,溶液的pH=___________ 。
(3)①已知25℃,NH3·H2O的 ,
, 的
的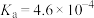 。亚硫酸电离常数为
。亚硫酸电离常数为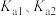 ,改变
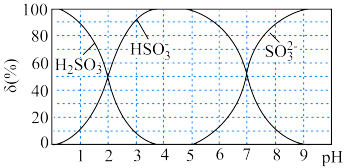
,改变 亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,
亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,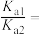
___________ 。
②将SO2通入氨水中,当 降至
降至 时,溶液中的
时,溶液中的
___________ ,
③将少量SO2通入NaNO2溶液发生反应的离子方程式为___________ 。
(1)以上物质中属于弱电解质的是
(2)已知在t1、t2温度下水的电离平衡曲线如图所示:

①t1温度时,若盐酸中
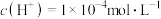 ,则由水电离产生的
,则由水电离产生的
 。
。②t2温度下将pH=2的稀硫酸与pH=10的KOH溶液等体积混合后,溶液的pH=
(3)①已知25℃,NH3·H2O的
 ,
, 的
的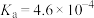 。亚硫酸电离常数为
。亚硫酸电离常数为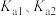 ,改变
,改变 亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,
亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,

②将SO2通入氨水中,当
 降至
降至 时,溶液中的
时,溶液中的
③将少量SO2通入NaNO2溶液发生反应的离子方程式为
您最近一年使用:0次
2023-10-15更新
|
1305次组卷
|
4卷引用:黑龙江省哈尔滨市第六中学校2022-2023学年高二上学期11月期中考试化学试题
2 . 在一定温度下,有三种酸溶液:a、盐酸 b、硫酸 c、醋酸。
(1)若三者溶液pH相同时,溶质的物质的量浓度由大到小的顺序是___________ (用a、b、c填空,下同)。
(2)若三者溶液同体积、同物质的量浓度时,溶液中 由大到小的顺序是
由大到小的顺序是___________ ,中和上述三种酸,消耗NaOH的物质的量由大到小的顺序是___________ 。
(3)若将pH相同的三种酸均加水稀释至原来的100倍后, 由大到小的顺序是
由大到小的顺序是___________ 。
(4)在0.2 与0.1
与0.1 醋酸中,
醋酸中, 之比为
之比为___________ 2∶1(填>、<、=)。
(5)在0.1 醋酸溶液中,
醋酸溶液中,
___________  (填数值)。
(填数值)。
(1)若三者溶液pH相同时,溶质的物质的量浓度由大到小的顺序是
(2)若三者溶液同体积、同物质的量浓度时,溶液中
 由大到小的顺序是
由大到小的顺序是(3)若将pH相同的三种酸均加水稀释至原来的100倍后,
 由大到小的顺序是
由大到小的顺序是(4)在0.2
 与0.1
与0.1 醋酸中,
醋酸中, 之比为
之比为(5)在0.1
 醋酸溶液中,
醋酸溶液中,
 (填数值)。
(填数值)。
您最近一年使用:0次
名校
3 . 我们的生活离不开化学,化学物质在不同的领域发挥着重要的作用。根据要求回答下列问题:
(1)工业上可用TiCl4制备纳米材料TiO2,用TiCl4制备TiO2∙xH2O的化学方程式是_______ 。
(2)乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向10mL 0.1 mol∙L-1 H2C2O4溶液中逐滴加入0.1 mol∙L-1NaOH溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:
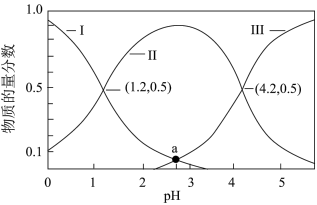
①等浓度的Na2C2O4和NaHC2O4混合溶液显_______ 性(填“酸”“碱”或“中”)并请通过计算说明_______ 。25℃时,草酸的电离平衡常数分别是Ka1、Ka2,则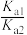 =
=_______ 。
②a点溶液中,c(Na+)_______ 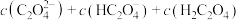 (填“>”“=”或“<”),此时溶液的pH=
(填“>”“=”或“<”),此时溶液的pH=_______ 。
(3)①酸性高锰酸钾应该用_______ 滴定管盛装(填“酸式”或“碱式”)。
②若要测定草酸亚铁晶体(FeC2O4∙xH2O)的x值,步骤如下:称取0.5400g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定,达到滴定终点时,消耗0.1000 mol∙L-1的酸性KMnO4溶液18.00mL。则x=_______ 。(FeC2O4的摩尔质量是144g/mol)
(1)工业上可用TiCl4制备纳米材料TiO2,用TiCl4制备TiO2∙xH2O的化学方程式是
(2)乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向10mL 0.1 mol∙L-1 H2C2O4溶液中逐滴加入0.1 mol∙L-1NaOH溶液,溶液中含碳微粒的物质的量分数随溶液pH变化如图所示:

①等浓度的Na2C2O4和NaHC2O4混合溶液显
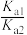 =
=②a点溶液中,c(Na+)
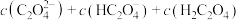 (填“>”“=”或“<”),此时溶液的pH=
(填“>”“=”或“<”),此时溶液的pH=(3)①酸性高锰酸钾应该用
②若要测定草酸亚铁晶体(FeC2O4∙xH2O)的x值,步骤如下:称取0.5400g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定,达到滴定终点时,消耗0.1000 mol∙L-1的酸性KMnO4溶液18.00mL。则x=
您最近一年使用:0次
2023-10-06更新
|
93次组卷
|
2卷引用:黑龙江省哈尔滨市松北区第九中学校2022-2023学年高二上学期12月期中考试化学试题
名校
解题方法
4 . 国家标准规定,酿造的食醋中醋酸的含量不得低于3.5g/100mL。选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:

(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后_______ 。
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为_______ mL。

③下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是_______ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后用白醋稀溶液润洗
D.滴定过程中摇动锥形瓶时有液滴溅出
E.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
F.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用0.1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1
NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1 的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。

①滴定醋酸的曲线是_______ (填“Ⅰ”或“Ⅱ”)。
②滴定醋酸时,M点时微粒浓度大小关系是_______ ( 除外)。
除外)。
③滴定醋酸过程中,下列关系正确的是_______ 。
A.M点时溶液中有: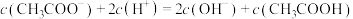
B.醋酸恰好反应完全时,溶液中有:
C.滴定过程中,曲线上任何一点,溶液中都有:
D.滴定过程中可能出现: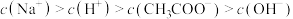
E.v=20mL时,溶液中有:
④若25℃时,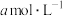 的醋酸与0.01
的醋酸与0.01 的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为_______ (用含a的代数式表示)。

(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后
②某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为

③下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后用白醋稀溶液润洗
D.滴定过程中摇动锥形瓶时有液滴溅出
E.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
F.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用0.1
 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1
NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1 的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
①滴定醋酸的曲线是
②滴定醋酸时,M点时微粒浓度大小关系是
 除外)。
除外)。③滴定醋酸过程中,下列关系正确的是
A.M点时溶液中有:
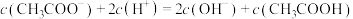
B.醋酸恰好反应完全时,溶液中有:

C.滴定过程中,曲线上任何一点,溶液中都有:

D.滴定过程中可能出现:
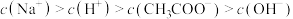
E.v=20mL时,溶液中有:

④若25℃时,
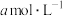 的醋酸与0.01
的醋酸与0.01 的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
您最近一年使用:0次
2023-10-06更新
|
87次组卷
|
2卷引用:黑龙江省哈尔滨市松北区第九中学校2022-2023学年高二上学期12月期中考试化学试题
名校
解题方法
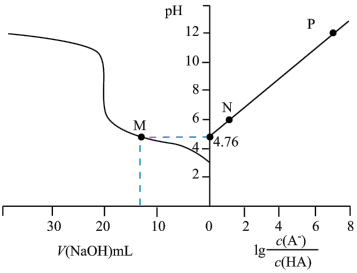
5 . 常温下,用0.1000 氢氧化钠溶液滴定一定浓度的HA溶液,溶液的pH与加入氢氧化钠溶液的体积
氢氧化钠溶液滴定一定浓度的HA溶液,溶液的pH与加入氢氧化钠溶液的体积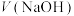 、
、 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是
 氢氧化钠溶液滴定一定浓度的HA溶液,溶液的pH与加入氢氧化钠溶液的体积
氢氧化钠溶液滴定一定浓度的HA溶液,溶液的pH与加入氢氧化钠溶液的体积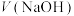 、
、 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是
| A.从N点到P点,水的电离程度逐渐变大 | B.M点对应的溶液中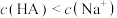 |
C.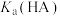 数量级为 数量级为 | D.滴定过程可采用酚酞作为指示剂 |
您最近一年使用:0次
2023-10-06更新
|
103次组卷
|
2卷引用:黑龙江省哈尔滨市松北区第九中学校2022-2023学年高二上学期12月期中考试化学试题
名校
解题方法
6 . 下列有关叙述正确的是
| A.非自发的反应一定可以通过改变条件使其成为自发反应 |
| B.25℃时,pH均为11的Na2CO3溶液和NaOH溶液,则由水电离的OH-离子浓度之比为108:1 |
| C.下列4种pH相同溶液①CH3COONa ②NaClO ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ |
| D.可用碱式滴定管准确量取11.50mL溴水 |
您最近一年使用:0次
2023-10-06更新
|
62次组卷
|
2卷引用:黑龙江省哈尔滨市松北区第九中学校2022-2023学年高二上学期12月期中考试化学试题
名校
解题方法
7 . 回答下列问题:
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)___________ 。实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的___________ 中,然后再用蒸馏水稀释到所需要的浓度,是为了抑制其水解。
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl;②CH3COOH ;③Ba(OH)2 ;④ Na2CO3 ;⑤ KCl ;⑥NH4Cl,溶液的pH由小到大的顺序为___________ (填序号)[已知Kb(NH3·H2O)=1.8×10-5,Ka(CH3COOH)=1.75×10-5]。
(3)写出1mol/L的NaH2PO4溶液中的电荷守恒表达式:___________
(4)泡沫灭火器(里面装饱和NaHCO3溶液和Al2(SO4)3)的工作原理(用离子方程式表示)___________
(5)不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___________ 。
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl;②CH3COOH ;③Ba(OH)2 ;④ Na2CO3 ;⑤ KCl ;⑥NH4Cl,溶液的pH由小到大的顺序为
(3)写出1mol/L的NaH2PO4溶液中的电荷守恒表达式:
(4)泡沫灭火器(里面装饱和NaHCO3溶液和Al2(SO4)3)的工作原理(用离子方程式表示)
(5)不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是
您最近一年使用:0次
名校
8 . 已知:pKa=-lgKa.25℃时,几种弱酸的pKa如表所示。下列说法正确的是
| 弱酸的化学式 | CH3COOH | HCOOH | H2SO3 | |
| pKa | 4.74 | 3.74 | 1.90 | 7.20 |
| A.25℃时,pH=8的甲酸钠溶液中,c(HCOOH)=9.9×10-7mol·L-1 |
| B.相同温度下,等浓度的HCOONa溶液比Na2SO3溶液的pH大 |
| C.25℃时,某乙酸溶液pH=a,则等浓度的甲酸pH=a-1 |
| D.向Na2SO3溶液中加入过量乙酸,反应生成SO2 |
您最近一年使用:0次
名校
解题方法
9 . 常温下某浓度的NaHSO3稀溶液的pH<7.则该稀溶液中下列粒子浓度关系正确的是
A.c(Na+)>c( )+c( )+c( ) ) |
B.c(Na+)>c( )>c(H2SO3)>c( )>c(H2SO3)>c( ) ) |
| C.c(H2SO3)+c(H+)=c(OH-) |
D.c(Na+)+c(H+)=c( )+c(OH-) )+c(OH-) |
您最近一年使用:0次
名校
解题方法
10 . 常温下,指定条件下,下列离子一定可以大量共存的是
A.pH=1的溶液中,Na+、Al3+、 、 、 |
B.由水电离出的c(H+)=1×10-13mol/L的溶液中,Na+、AlO 、 、 、 、 |
C.Na+、 、 、 、Cl- 、Cl- |
D.Na+、Al3+、AlO 、 、 |
您最近一年使用:0次



