名校
1 . 维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)若25℃时, 的醋酸与0.1mol/L的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的醋酸与0.1mol/L的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为___________ (用含a的代数式表示)。
(2)常温下,在不同试剂中加入酸或碱后体系pH的变化如表所示。
①
___________ (忽略加入NaOH前后体系的体积变化)。
②结合化学用语解释试剂ⅱ显酸性的原因:___________ 。
③试剂ⅱ中微粒浓度关系正确的有___________ (填序号)。
a.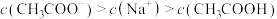
b.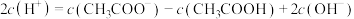
c.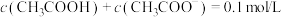
④由表中数据可知,试剂ⅱ的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是_______ (填序号)。
a.NaCN—HCN b.H2SO4—NaHSO4 c.NH3·H2O—NH4Cl d.NaCl—HCl
(1)若25℃时,
 的醋酸与0.1mol/L的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的醋酸与0.1mol/L的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为(2)常温下,在不同试剂中加入酸或碱后体系pH的变化如表所示。
| 试剂 | pH | ||
| 初始 | 通入0.01molHCl气体 | 加入0.01molNaOH固体 | |
| ⅰ。1LH2O | 7 | 2 | a |
| ⅱ。0.10molCH3COOH、0.10molCH3COONa配制成1L的溶液 | 4.76 | 4.67 | 4.85 |

②结合化学用语解释试剂ⅱ显酸性的原因:
③试剂ⅱ中微粒浓度关系正确的有
a.
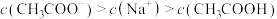
b.
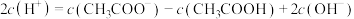
c.
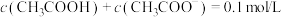
④由表中数据可知,试剂ⅱ的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是
a.NaCN—HCN b.H2SO4—NaHSO4 c.NH3·H2O—NH4Cl d.NaCl—HCl
您最近一年使用:0次
名校
2 . 根据下列实验操作和实验现象,得出相应实验结论错误的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向AgCl悬浊液中加入少量KI固体 | 沉淀由白色转化为黄色 |  |
| B | 向2mL 的FeCl3溶液中加入足量铁粉,振荡,加1滴KSCN溶液 的FeCl3溶液中加入足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: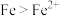 |
| C | 测定饱和NaHCO3溶液与饱和Na2CO3溶液的pH | 后者pH更大 |  的水解程度小于 的水解程度小于 |
| D | 向滴有酚酞的Na2SO3溶液中加入少量BaCl2固体 | 生成白色沉淀,且红色逐渐变浅 | Na2SO3溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 室温下,下列溶液中粒子浓度关系正确的是
A.K2S溶液: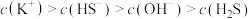 |
B.NaHC2O4溶液: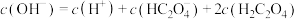 |
C.pH=5的NaHSO3溶液: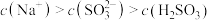 |
D.CH3COONa和CaCl2混合溶液: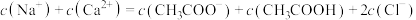 |
您最近一年使用:0次
名校
4 . 弱电解质的研究是重要课题。室温下,H2SeO3电离平衡体系中含Se微粒的物质的量分数与溶液PH的关系如图所示,回答下列问题:
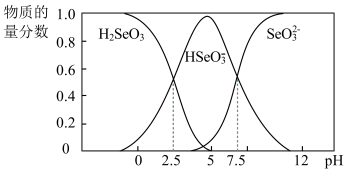
(1)写出NaHSeO3水解常数的表达式___________
(2)写出将将少量氢氧化钠溶液滴入H2SeO3溶液中的离子方程式:___________
(3)NaHSeO3溶液显___________ 性,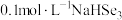 溶液中,离子浓度由大到小的顺序为
溶液中,离子浓度由大到小的顺序为___________ 。
(4)计算,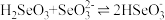 的平衡常数K=
的平衡常数K=___________

(1)写出NaHSeO3水解常数的表达式
(2)写出将将少量氢氧化钠溶液滴入H2SeO3溶液中的离子方程式:
(3)NaHSeO3溶液显
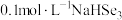 溶液中,离子浓度由大到小的顺序为
溶液中,离子浓度由大到小的顺序为(4)计算,
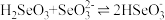 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
2023-09-02更新
|
321次组卷
|
2卷引用:山东省聊城第一中学2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
5 . 下列事实与盐类水解无关的是
| A.配制FeCl3溶液,需用盐酸溶解FeCl3固体 |
| B.NaHSO4水溶液呈酸性 |
| C.加热蒸干CuCl2溶液得到Cu(OH)2固体 |
D.要除去FeCl3溶液中混有的 ,可通入适量氧化剂Cl2 ,可通入适量氧化剂Cl2 |
您最近一年使用:0次
解题方法
6 . 铵盐在日常生活中用处广泛, 常作食品加工中的食品添加剂,用于焙烤食品;
常作食品加工中的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1) 可作净水剂,其原理是
可作净水剂,其原理是_____ (用离子方程式说明)。
(2)相同条件下,下列五种溶液中 由大到小的顺序是
由大到小的顺序是_____ 。
①
 溶液②
溶液②
 溶液③
溶液③
 溶液④
溶液④ 氨水⑤
氨水⑤ 溶液
溶液
(3)25℃时,已知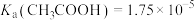
 。则判断常温下,
。则判断常温下, 溶液中的
溶液中的
_____ 7(填“>”“=”或“<”),理由是_____ 。
(4)下列图像为0.1mol/L的几种电解质溶液的 随温度变化的曲线。
随温度变化的曲线。

其中符合
 溶液的
溶液的 随温度变化的曲线是
随温度变化的曲线是_____ (填罗马数字), 溶液的
溶液的 随温度变化的原因是
随温度变化的原因是_____ 。
(5)室温时,向100mL
 溶液中滴加
溶液中滴加
 溶液,溶液
溶液,溶液 与加入
与加入 溶液体积的关系曲线如图所示。
溶液体积的关系曲线如图所示。

①试分析图中a、b、c、d四个点,水的电离程度最大的是_____ 点。
②在b点,溶液中各离子浓度由大到小的排列顺序是_____ 。
 常作食品加工中的食品添加剂,用于焙烤食品;
常作食品加工中的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
在分析试剂、医药、电子工业中用途广泛。请回答下列问题:(1)
 可作净水剂,其原理是
可作净水剂,其原理是(2)相同条件下,下列五种溶液中
 由大到小的顺序是
由大到小的顺序是①

 溶液②
溶液②
 溶液③
溶液③
 溶液④
溶液④ 氨水⑤
氨水⑤ 溶液
溶液(3)25℃时,已知
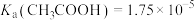
 。则判断常温下,
。则判断常温下, 溶液中的
溶液中的
(4)下列图像为0.1mol/L的几种电解质溶液的
 随温度变化的曲线。
随温度变化的曲线。
其中符合

 溶液的
溶液的 随温度变化的曲线是
随温度变化的曲线是 溶液的
溶液的 随温度变化的原因是
随温度变化的原因是(5)室温时,向100mL

 溶液中滴加
溶液中滴加
 溶液,溶液
溶液,溶液 与加入
与加入 溶液体积的关系曲线如图所示。
溶液体积的关系曲线如图所示。
①试分析图中a、b、c、d四个点,水的电离程度最大的是
②在b点,溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
7 . 常温下,已知亚磷酸 溶液中含磷微粒的浓度之和为0.1mol/L,测得溶液中各含磷微粒的
溶液中含磷微粒的浓度之和为0.1mol/L,测得溶液中各含磷微粒的 关系如图所示。已知:
关系如图所示。已知: ,
, ;x、z两点的坐标为
;x、z两点的坐标为 、
、 ,下列说法正确的是
,下列说法正确的是

 溶液中含磷微粒的浓度之和为0.1mol/L,测得溶液中各含磷微粒的
溶液中含磷微粒的浓度之和为0.1mol/L,测得溶液中各含磷微粒的 关系如图所示。已知:
关系如图所示。已知: ,
, ;x、z两点的坐标为
;x、z两点的坐标为 、
、 ,下列说法正确的是
,下列说法正确的是
A.表示 随 随 变化的曲线是② 变化的曲线是② |
B.常温下, 溶液中的 溶液中的 |
C.亚磷酸 的电离平衡常数 的电离平衡常数 |
D. 与足量的 与足量的 溶液反应的离子方程式为 溶液反应的离子方程式为 |
您最近一年使用:0次
名校
8 . 国家标准规定,酿造的食醋中醋酸的含量不得低于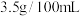 ,即每
,即每 食醋中,折算成的醋酸含量不得低于
食醋中,折算成的醋酸含量不得低于 。选择酚酞作指示剂,用标准
。选择酚酞作指示剂,用标准 溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
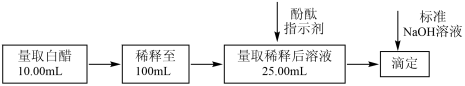
(1)①滴定达到终点时的现象是滴入半滴标准 溶液后
溶液后___________ 。
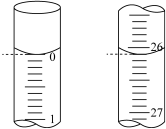
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗 溶液的体积为
溶液的体积为___________  。
。
③已知实验所用标准 溶液的浓度为
溶液的浓度为 ,根据上述滴定结果可知该白醋
,根据上述滴定结果可知该白醋___________ (填“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是___________ (填编号)。
A.碱式滴定管未用标准 溶液润洗就直接注入标准
溶液润洗就直接注入标准 溶液
溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取 溶液体积时,开始时仰视读数,滴定结束时俯视读数
溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中
的盐酸和醋酸溶液,得到滴定过程中 随加入
随加入 溶液体积而变化的两条滴定曲线如图所示。
溶液体积而变化的两条滴定曲线如图所示。
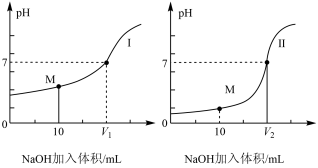
①滴定醋酸的曲线是___________ (填“Ⅰ”或“Ⅱ”)。
②若25℃时, 的醋酸与
的醋酸与 的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为___________ (用含a的代数式表示)。
(3)乙二酸 俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向
俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向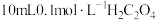 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳微粒的物质的量分数随溶液
溶液,溶液中含碳微粒的物质的量分数随溶液 变化如图所示:
变化如图所示:

①当滴入 溶液的体积为
溶液的体积为 时,混合溶液显
时,混合溶液显___________ 性。(填“酸”“碱”或“中”);
②a点溶液中的
___________ 。
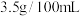 ,即每
,即每 食醋中,折算成的醋酸含量不得低于
食醋中,折算成的醋酸含量不得低于 。选择酚酞作指示剂,用标准
。选择酚酞作指示剂,用标准 溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
(1)①滴定达到终点时的现象是滴入半滴标准
 溶液后
溶液后②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗
 溶液的体积为
溶液的体积为 。
。
③已知实验所用标准
 溶液的浓度为
溶液的浓度为 ,根据上述滴定结果可知该白醋
,根据上述滴定结果可知该白醋④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是
A.碱式滴定管未用标准
 溶液润洗就直接注入标准
溶液润洗就直接注入标准 溶液
溶液B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取
 溶液体积时,开始时仰视读数,滴定结束时俯视读数
溶液体积时,开始时仰视读数,滴定结束时俯视读数E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用
 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中
的盐酸和醋酸溶液,得到滴定过程中 随加入
随加入 溶液体积而变化的两条滴定曲线如图所示。
溶液体积而变化的两条滴定曲线如图所示。
①滴定醋酸的曲线是
②若25℃时,
 的醋酸与
的醋酸与 的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为(3)乙二酸
 俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向
俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向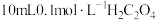 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳微粒的物质的量分数随溶液
溶液,溶液中含碳微粒的物质的量分数随溶液 变化如图所示:
变化如图所示:
①当滴入
 溶液的体积为
溶液的体积为 时,混合溶液显
时,混合溶液显②a点溶液中的

您最近一年使用:0次
名校
9 . 根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向2支均盛有2mL相同浓度的 溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 |  |
| B | 将红热的木炭放入盛有浓硝酸的试管中,试管中有红棕色气体产生 | 木炭与浓硝酸反应产生 |
| C | 用pH试纸测得: 溶液的pH约为9, 溶液的pH约为9, 溶液的pH约为8 溶液的pH约为8 |  电离出 电离出 的能力比 的能力比 的强 的强 |
| D | 向盛有相同浓度 溶液的两支试管中,分别滴加淀粉溶液和 溶液的两支试管中,分别滴加淀粉溶液和 溶液,前者溶液变蓝,后者有黄色沉淀 溶液,前者溶液变蓝,后者有黄色沉淀 | 溶液中可能存在平衡: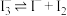 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-13更新
|
188次组卷
|
5卷引用:山东省济宁市育才中学2022-2023学年高二上学期第二次学情检测化学试题
解题方法
10 . 草酸( )是一种二元弱酸。常温下,向
)是一种二元弱酸。常温下,向 溶液中逐滴加入NaOH溶液,混合溶液中
溶液中逐滴加入NaOH溶液,混合溶液中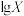 [
[ 为
为 或
或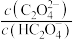 ]与pH的变化关系如图所示。下列说法正确的是
]与pH的变化关系如图所示。下列说法正确的是

 )是一种二元弱酸。常温下,向
)是一种二元弱酸。常温下,向 溶液中逐滴加入NaOH溶液,混合溶液中
溶液中逐滴加入NaOH溶液,混合溶液中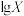 [
[ 为
为 或
或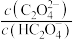 ]与pH的变化关系如图所示。下列说法正确的是
]与pH的变化关系如图所示。下列说法正确的是
A.直线II表示 随溶液pH的变化,且 随溶液pH的变化,且 |
B.pH=1.22的溶液中: |
C.当pH=4.19时,溶液中 |
D.已知:25℃时, 的电离常数为 的电离常数为 ,则 ,则 溶液呈碱性 溶液呈碱性 |
您最近一年使用:0次



