名校
1 . 在室温下,下列四种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1mol/L NH4HSO4溶液,④0.1 mol/L氨水。
(1)溶液①呈酸性的原因是___________ (用离子方程式表示)。
(2)溶液③的电离方程式为___________
(3)在上述①、②、 ③、④溶液中c ( )浓度由大到小的顺序是
)浓度由大到小的顺序是___________ (填序号)。
(4)25℃时,将pH=9的NaOH溶液与p=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为___________ 。
(5)25℃时,向0.1mol/L FeCl3溶液中加入④溶液,若Fe(OH)3的Ksp=1×10-39,当铁离子恰好完全沉淀时[当c(Fe3+)小于10-6mol/L时,可忽略不计],溶液的pH=___________ 。
(1)溶液①呈酸性的原因是
(2)溶液③的电离方程式为
(3)在上述①、②、 ③、④溶液中c (
 )浓度由大到小的顺序是
)浓度由大到小的顺序是(4)25℃时,将pH=9的NaOH溶液与p=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(5)25℃时,向0.1mol/L FeCl3溶液中加入④溶液,若Fe(OH)3的Ksp=1×10-39,当铁离子恰好完全沉淀时[当c(Fe3+)小于10-6mol/L时,可忽略不计],溶液的pH=
您最近一年使用:0次
2 . 已知25℃时,部分弱电解质的电离平衡常数数据如下表:
回答下列问题:
(1)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的 由小到大的顺序为
由小到大的顺序为___________ (填字母序号)。
(2)常温下,0.1mol/L醋酸溶液加水稀释过程中,下列表达式的数据减小的是___________(填字母序号)。
(3)25℃时,将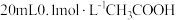 溶液和
溶液和 溶液分别与
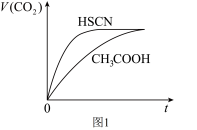
溶液分别与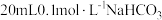 溶液混合,实验测得产生的气体体积(V)随时间(t)变化如图1所示:反应初始阶段两种溶液产生
溶液混合,实验测得产生的气体体积(V)随时间(t)变化如图1所示:反应初始阶段两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是___________ 反应结束后所得两溶液中,c(SCN-)_________ c(CH3COO-)(填“>”“<”或“=”)。
(4)体积均为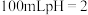 的
的 与一元酸
与一元酸 ,加水稀释过程中
,加水稀释过程中 与溶液体积的关系如图2所示,则
与溶液体积的关系如图2所示,则 的电离平衡常数
的电离平衡常数___________ (填“大于”、“小于”或“等于”) 的电离平衡常数。
的电离平衡常数。

(5)25℃时,在 与
与 的混合溶液中,若测得
的混合溶液中,若测得 ,则溶液中
,则溶液中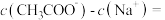
________ mol/L(填精确值),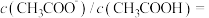
___________ 。
| 弱酸化学式 |  |  |  |  |
| 电离平衡常数 | 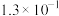 |  | 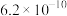 | 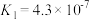 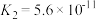 |
(1)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的
 由小到大的顺序为
由小到大的顺序为(2)常温下,0.1mol/L醋酸溶液加水稀释过程中,下列表达式的数据减小的是___________(填字母序号)。
A. | B. |
C.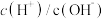 | D. |
(3)25℃时,将
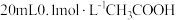 溶液和
溶液和 溶液分别与
溶液分别与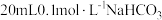 溶液混合,实验测得产生的气体体积(V)随时间(t)变化如图1所示:反应初始阶段两种溶液产生
溶液混合,实验测得产生的气体体积(V)随时间(t)变化如图1所示:反应初始阶段两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是
(4)体积均为
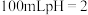 的
的 与一元酸
与一元酸 ,加水稀释过程中
,加水稀释过程中 与溶液体积的关系如图2所示,则
与溶液体积的关系如图2所示,则 的电离平衡常数
的电离平衡常数 的电离平衡常数。
的电离平衡常数。
(5)25℃时,在
 与
与 的混合溶液中,若测得
的混合溶液中,若测得 ,则溶液中
,则溶液中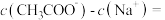
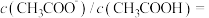
您最近一年使用:0次
3 . 常温下,将0.1mol/L的二元弱酸H2A溶液与NaOH溶液混合,H2A、HA-、A2-的物质的量浓度分数 随体系pH的变化如图所示【已知
随体系pH的变化如图所示【已知 】。下列叙述错误的是
】。下列叙述错误的是
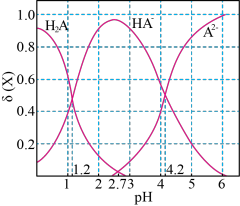
 随体系pH的变化如图所示【已知
随体系pH的变化如图所示【已知 】。下列叙述错误的是
】。下列叙述错误的是 
A. 时,溶液中一定存在c(Na+)+c(H+)=c(OH-)+3c(HA-) 时,溶液中一定存在c(Na+)+c(H+)=c(OH-)+3c(HA-) |
B.常温下,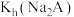 的数量级为 的数量级为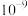 |
C. 时, 时,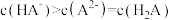 |
| D.混合溶液始终存在c(Na+)= c(HA-)+2c(A2-) |
您最近一年使用:0次
4 . 下列说法正确的是
A.常温下, 的 的 溶液中,由水电离的 溶液中,由水电离的 |
B.将 的 的 溶液和 溶液和 的 的 溶液等体积混合,所得溶液 溶液等体积混合,所得溶液 |
C. 氨水和 氨水和 溶液等体积混合后所得溶液pH>7,则c(NH 溶液等体积混合后所得溶液pH>7,则c(NH )>c(NH3·H2O) )>c(NH3·H2O) |
D.向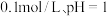 的 的 溶液中加入 溶液中加入 溶液反应的离子方程式为: 溶液反应的离子方程式为: |
您最近一年使用:0次
5 . 亚磷酸(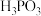 )是一种二元弱酸,常温下电离常数
)是一种二元弱酸,常温下电离常数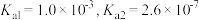 ,下列说法正确的是
,下列说法正确的是
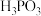 )是一种二元弱酸,常温下电离常数
)是一种二元弱酸,常温下电离常数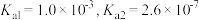 ,下列说法正确的是
,下列说法正确的是A.H3PO3与足量的 溶液反应生成的Na2HPO3是酸式盐 溶液反应生成的Na2HPO3是酸式盐 |
| B.NaH2PO3溶液显酸性 |
C.向亚磷酸溶液中加入少量 固体,则 固体,则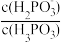 变小 变小 |
D.对 的亚磷酸溶液加水稀释,溶液中所有离子浓度均减小 的亚磷酸溶液加水稀释,溶液中所有离子浓度均减小 |
您最近一年使用:0次
解题方法
6 . I.已知水在25℃和95℃时的电离平衡曲线如图所示:

(1)25℃时水的电离平衡曲线应为_______ (填“A”或“B”)。
(2)95℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______ 。
(3)25℃时,等体积的pH=12的NaOH溶液和氨水分别与0.1mol•L-1的盐酸发生中和反应,恰好完全反应时消耗盐酸的体积_______ (填“前者多”“后者多”或“一样多”)。
Ⅱ.NaOH溶液可用于多种气体的处理。
(4)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。Na2CO3俗称纯碱,因CO 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO 第一步水解的离子方程式
第一步水解的离子方程式_______ 。已知25℃时,CO 第一步水解的平衡常数Kh=2×10-4,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4,当溶液中c(HCO ):c(CO
):c(CO )=20:1时,溶液的pH=
)=20:1时,溶液的pH=_______ 。
(5)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1CH3COONa溶液,则两份溶液中c(NO )、c(NO
)、c(NO )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为_______ (已知HNO2的电离常数Ka=5.6×10-4,CH3COOH的电离常数Ka=1.75×10-5)。可使溶液A和溶液B的pH相等的方法是_______ (填字母)。
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水

(1)25℃时水的电离平衡曲线应为
(2)95℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)25℃时,等体积的pH=12的NaOH溶液和氨水分别与0.1mol•L-1的盐酸发生中和反应,恰好完全反应时消耗盐酸的体积
Ⅱ.NaOH溶液可用于多种气体的处理。
(4)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。Na2CO3俗称纯碱,因CO
 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO 第一步水解的离子方程式
第一步水解的离子方程式 第一步水解的平衡常数Kh=2×10-4,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4,当溶液中c(HCO ):c(CO
):c(CO )=20:1时,溶液的pH=
)=20:1时,溶液的pH=(5)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1CH3COONa溶液,则两份溶液中c(NO
 )、c(NO
)、c(NO )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
您最近一年使用:0次
名校
解题方法
7 . T℃时,纯水电离的c(OH-)为1×10-6mol/L。该温度下,如果取0.1mol/LHB溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=7。试回答以下问题:
(1)混合溶液的pH=7的原因:_______ (用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)_______ (填“>”“<”或“=”)0.1mol/LNaOH溶液中由水电离出的c(OH-)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(B-)=_______ mol/L,c(OH-)-c(HB)=_______ mol/L。
(4)已知NH4B溶液为中性,又知HB溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液中的:c(H+)_______ c(OH-) (填“>”“<”或“=”);将同温度下等浓度的四种盐溶液按pH由小到大的顺序排列是_______ (填序号)。
A.NH4HCO3 B.NH4B C.(NH4)2SO4 D.NH4Cl
(5)T℃时,现有pH=x的盐酸和pH=y的氢氧化钠溶液,取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,若x+y=13,则a:b=_______ (填数值);
(1)混合溶液的pH=7的原因:
(2)混合溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(B-)=
(4)已知NH4B溶液为中性,又知HB溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液中的:c(H+)
A.NH4HCO3 B.NH4B C.(NH4)2SO4 D.NH4Cl
(5)T℃时,现有pH=x的盐酸和pH=y的氢氧化钠溶液,取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,若x+y=13,则a:b=
您最近一年使用:0次
名校
8 . Ⅰ.亚硫酸氢钠在医药、印染等行业用作抗氧化剂、漂白剂,回答下列问题:
(1)SO2易溶于水,常温常压下溶解度为1∶40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是_____ (结合有关平衡方程式简要说明)。
(2)①请设计简单实验方案比较室温下NaHSO3溶液中 的电离平衡常数
的电离平衡常数 与水解平衡常数
与水解平衡常数 的相对大小:
的相对大小:_____ 。
②25℃时, 的电离常数
的电离常数 ,则该温度pH=3,
,则该温度pH=3, 的NaHSO3溶液中
的NaHSO3溶液中
_____ 。
Ⅱ.在氯化铁溶液中存在下列平衡: 。回答下列问题:
。回答下列问题:
(3)不断加热FeCl3溶液,蒸干其水分并充分灼烧得到的固体是_____ 。
(4)在配制FeCl3溶液时,为防止浑浊,应加入_____ 。
(5)为了除去MgCl2酸性溶液中的 ,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去
,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去 的原因是
的原因是_____ 。
(1)SO2易溶于水,常温常压下溶解度为1∶40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是
(2)①请设计简单实验方案比较室温下NaHSO3溶液中
 的电离平衡常数
的电离平衡常数 与水解平衡常数
与水解平衡常数 的相对大小:
的相对大小:②25℃时,
 的电离常数
的电离常数 ,则该温度pH=3,
,则该温度pH=3, 的NaHSO3溶液中
的NaHSO3溶液中
Ⅱ.在氯化铁溶液中存在下列平衡:
 。回答下列问题:
。回答下列问题:(3)不断加热FeCl3溶液,蒸干其水分并充分灼烧得到的固体是
(4)在配制FeCl3溶液时,为防止浑浊,应加入
(5)为了除去MgCl2酸性溶液中的
 ,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去
,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)某温度时,测得 的NaOH溶液的pH为11,则该温度下水的离子积常数
的NaOH溶液的pH为11,则该温度下水的离子积常数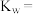
_____ ,该温度(填“>”“<”或“=”)_____ 25℃。
(2)明矾净水的原理是:_____ (用离子方程式表示)。
(3)滴定实验中,酸性高锰酸钾标准液装在_____ (填“酸式”或“碱式”)滴定管中。
(4)常温下,将pH=2的醋酸和盐酸各1mL分别稀释至100mL,稀释后pH:醋酸_____ 盐酸(填“>”“<”或“=”)。稀释后溶液中水的电离程度:醋酸_____ 盐酸(填“>”“<”或“=”)。
(5)常温下,等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系为_____ 。
(6)常温下,向10mL浓度均为 的HCl和CH3COOH的混合溶液中加入等体积
的HCl和CH3COOH的混合溶液中加入等体积 的NaOH溶液,充分反应后混合溶液呈
的NaOH溶液,充分反应后混合溶液呈_____ (填“酸性”“碱性”或“中性”),混合溶液中离子浓度由大到小的顺序为_____ 。
(7)常温下,用pH=4和pH=11的强酸和强碱混合,使pH=10,则酸、碱溶液的体积比为_____ 。
(1)某温度时,测得
 的NaOH溶液的pH为11,则该温度下水的离子积常数
的NaOH溶液的pH为11,则该温度下水的离子积常数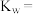
(2)明矾净水的原理是:
(3)滴定实验中,酸性高锰酸钾标准液装在
(4)常温下,将pH=2的醋酸和盐酸各1mL分别稀释至100mL,稀释后pH:醋酸
(5)常温下,等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系为
(6)常温下,向10mL浓度均为
 的HCl和CH3COOH的混合溶液中加入等体积
的HCl和CH3COOH的混合溶液中加入等体积 的NaOH溶液,充分反应后混合溶液呈
的NaOH溶液,充分反应后混合溶液呈(7)常温下,用pH=4和pH=11的强酸和强碱混合,使pH=10,则酸、碱溶液的体积比为
您最近一年使用:0次
名校
解题方法
10 . 25℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
 H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是| A.将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向纯水中加入少量Na2CO3固体,c(OH-)增大,Kw不变,影响水的电离平衡 |
D.向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中 减小 减小 |
您最近一年使用:0次
2023-09-15更新
|
947次组卷
|
7卷引用:江西省南昌市第一中学2022-2023学年高二上学期11月期中考试化学试题



