名校
解题方法
1 . 已知HF的酸性强于CH3COOH,常温下有下列三种溶液,有关叙述中不正确的是
| 编号 | ① | ② | ③ |
| pH | 11 | 3 | 3 |
| 溶液 | NaOH溶液 | CH3COOH溶液 | HF溶液 |
| A.②、③混合后: c(H+)=c(F-)+c(CH3COO-)+c(OH-) |
| B.①、②等体积混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.中和相同体积的②、③,需消耗相同体积的① |
| D.向③中加入CH3COONa固体,HF的电离平衡向右移动 |
您最近一年使用:0次
名校
解题方法
2 . 下列离子方程式书写正确的是
A.NaHCO3的电离:NaHCO3  Na+ + Na+ +  |
| B.铁与稀硝酸反应:Fe +2H+ = Fe 2+ + H2↑ |
C.AlCl3溶液与Na2S溶液反应:2Al3++ 3S2-+ 6H2O  2Al(OH)3 + 3H2S 2Al(OH)3 + 3H2S |
D.以Pt为电极材料电解AgNO3溶液:4Ag+ + 2H2O 4Ag + O2↑+ 4H+ 4Ag + O2↑+ 4H+ |
您最近一年使用:0次
名校
解题方法
3 . 填空题(共12分)
(1)室温下,将等体积的氨水与盐酸溶液混合后,若混合溶液中c( )=c(Cl-),则溶液中的pH值
)=c(Cl-),则溶液中的pH值____ 7(填“>”、“<”或“=”,下同),混合前c(NH3·H2O)_____ c(HCl)
(2)等浓度的NH4Cl和氨水溶液中,水电离出的H+浓度,前者______ 后者。
(3)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______ 。
(4)在配制硫化钠溶液时,为了抑制水解,可以加入少量的________ 。
(5)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10−1),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10−1 mol∙L−1,则生成沉淀所需CaCl2溶液的最小浓度为________ 。
(1)室温下,将等体积的氨水与盐酸溶液混合后,若混合溶液中c(
 )=c(Cl-),则溶液中的pH值
)=c(Cl-),则溶液中的pH值(2)等浓度的NH4Cl和氨水溶液中,水电离出的H+浓度,前者
(3)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(4)在配制硫化钠溶液时,为了抑制水解,可以加入少量的
(5)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10−1),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10−1 mol∙L−1,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
名校
4 . 某溶液中由水电离出来的C(OH-)=10-12mol/L,则该溶液不可能是
| A.HCl | B.NaOH | C.NaHSO4 | D.NH4Cl |
您最近一年使用:0次
名校
解题方法
5 . 常温下,将一定浓度的HA和HB两种酸溶液分别与0.1mol•L﹣1NaOH溶液等体积混合,实验记录如表:
下列说法正确的是
| 混合液 | pH | 加入的酸 | 酸的浓度/(mol•L﹣1) |
| ① | 8.6 | HA | 0.10 |
| ② | 2.0 | HB | 0.12 |
| A.HA为强酸,HB为弱酸 |
| B.溶液①中存在:c(A﹣)>c(Na+)>c(OH﹣)>c(H+) |
| C.升高温度,溶液①中c(A﹣)﹣c(HA)的值会增大 |
| D.溶液②中存在:c(Na+)+c(H+)=c(OH﹣)+(B﹣) |
您最近一年使用:0次
2023-03-22更新
|
274次组卷
|
2卷引用:重庆市第一中学校2020-2021学年高二下学期期末考试化学试题
名校
解题方法
6 . 常温下,向20mL0.2mol·L-1H2A溶液中滴加0.2mol·L-1NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是


| A.当V(NaOH溶液)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B.NaHA溶液中:c(OH-)+2c(A2-)=c(H+)+c(H2A) |
| C.当V(NaOH溶液)=40mL时,其溶液中水的电离程度比纯水大 |
| D.向Na2A溶液加入水的过程中,pH可能增大也可能减小 |
您最近一年使用:0次
名校
解题方法
7 . NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol·L-1NH4Al(SO4)2中
_______ (填“等于”、“大于”或“小于”)0.1mol·L-1NH4HSO4中 。
。
(2)如图1所示是0.1mol·L-1电解质溶液的pH随温度变化的图像。
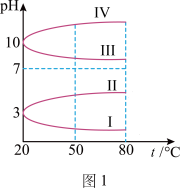
①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_______ (填序号),导致pH随温度变化的原因是_______ 。
②20℃时,0.1mol·L-1NH4Al(SO4)2中
_______ mol·L-1。
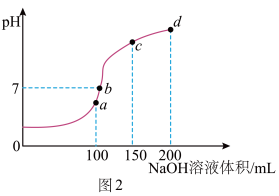
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,所得溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)相同条件下,0.1mol·L-1NH4Al(SO4)2中

 。
。(2)如图1所示是0.1mol·L-1电解质溶液的pH随温度变化的图像。

①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是
②20℃时,0.1mol·L-1NH4Al(SO4)2中

(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,所得溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是

您最近一年使用:0次
2023-01-20更新
|
119次组卷
|
2卷引用:重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)
名校
8 . 下列实验操作、现象及根据现象得出的结论,都正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用食醋浸泡水垢[水垢主要成分:CaCO3与Mg(OH)2] | 水垢溶解,有无色气泡产生 | 碱性:CH3COONa>Na2CO3 |
| B | 向CH3COONa溶液中滴加酚酞,加热 | 溶液红色加深 | 水解是吸热过程 |
| C | 向滴有酚酞的NaOH溶液中通入SO2 | 溶液红色褪去 | SO2具有漂白性 |
| D | 用广范pH试纸测定新制氯水的pH | pH=3.0 | 氯水呈酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
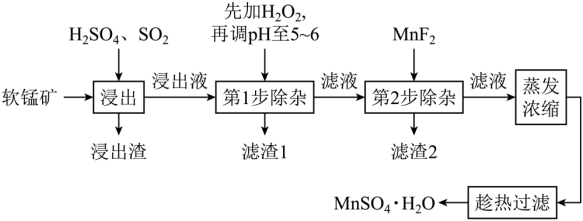
已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为___________ 。
(2)第1步除杂中加入H2O2的目的是___________ 。
(3)第1步除杂中形成滤渣1的主要成分为___________ (填化学式),调pH至5~6所加的试剂,可选择___________ (填以下试剂的序号字母)。
a.CaO b.MnCO3 c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式:___________ 。(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11)
(5)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是___________ (用离子方程式表示)。
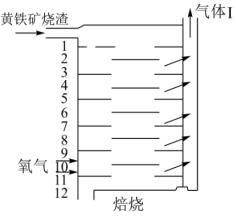
(6)工艺流程中矿渣的预处理通常有酸浸、碱浸、焙烧等方式。黄铁矿渣焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是___________ (任答两点)。

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为
(2)第1步除杂中加入H2O2的目的是
(3)第1步除杂中形成滤渣1的主要成分为
a.CaO b.MnCO3 c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式:
(5)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是
(6)工艺流程中矿渣的预处理通常有酸浸、碱浸、焙烧等方式。黄铁矿渣焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是

您最近一年使用:0次
10 . 完成下列问题
(1)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸(H3PO3)的结构如图,亚磷酸可由PCl3水解而成,H3PO3溶液存在电离平衡:H3PO3 H++H2PO
H++H2PO ,H2PO
,H2PO
 H++HPO
H++HPO

回答下列问题:
①Na2HPO3属于___________ (填“正盐”或“酸式盐”)。
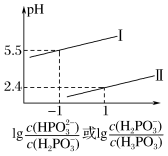
②常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示 的是曲线
的是曲线___________ (填“I”或“Ⅱ”),亚磷酸(H3PO3)的Ka2=___________ 。
(2)25℃时,部分弱碱、弱酸的电离平衡常数如下表:
①向Na2CO3溶液中加入少量的H3PO4溶液反应的离子方程式是___________ 。
②0.1mol/L的NH4NO2溶液中离子浓度大小关系是___________ 。
(3)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为___________ 。(100℃时:Kw=10-12)
(4)已知:Ksp(AgBr)=5.4×10−13,Ksp(AgCl)=1.8×10−10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
=___________ 。
(5)已知在25℃时,Ksp[Mg(OH)2]=3.2×10−11.25℃时,向0.02 mol∙L−1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的pH最小是___________ (已知lg2=0.3)。
(1)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸(H3PO3)的结构如图,亚磷酸可由PCl3水解而成,H3PO3溶液存在电离平衡:H3PO3
 H++H2PO
H++H2PO ,H2PO
,H2PO
 H++HPO
H++HPO

回答下列问题:
①Na2HPO3属于
②常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示
 的是曲线
的是曲线
(2)25℃时,部分弱碱、弱酸的电离平衡常数如下表:
| 弱酸 | NH3·H2O | HNO2 | H2CO3 | H3PO4 |
| 电离平衡常数(25℃) | Kb=1.8×10-5 | Ka=5.0×10-4 | Ka1=4.0×10-7 Ka2=5.0×10-11 | Ka1=8.0×10-3 Ka2=6.0×10-8 Ka3=2.0×10-13 |
②0.1mol/L的NH4NO2溶液中离子浓度大小关系是
(3)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为
(4)已知:Ksp(AgBr)=5.4×10−13,Ksp(AgCl)=1.8×10−10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
 =
=(5)已知在25℃时,Ksp[Mg(OH)2]=3.2×10−11.25℃时,向0.02 mol∙L−1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的pH最小是
您最近一年使用:0次
2022-12-26更新
|
156次组卷
|
2卷引用:重庆市三峡名校联盟2022-2023学年高二上学期秋季联考化学试题



