1 . 下列关于价电子排布3s23p4的描述正确的是
| A.它的元素符号为O |
| B.它的核外电子排布式为1s22s22p63s23p4 |
| C.可以与H2化合生成液态化合物 |
D.其电子排布图为 |
您最近一年使用:0次
2024-04-13更新
|
232次组卷
|
44卷引用:重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)
重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)宁夏青铜峡市高级中学2021-2022学年高二上学期期末考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年高二下学期第一次月考化学试题(已下线)吉林一中2009--2010学年度下学期期末考试第一次质量检测高二化学试卷(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2011-2012学年内蒙古包头三十三中高二下学期期中考试化学试卷(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷2013-2014山东省即墨市高二下学期期中考试化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷宁夏育才中学2016-2017学年高二下学期期中考试化学试题江苏省盘湾中学、陈洋中学2017-2018学年高二上学期期中联考(选修)化学试题2016-2017学年高中化学选修3(人教版)模块综合测评【全国校级联考】新疆昌吉市教育共同体四校2017-2018学年高二下学期期末联考化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高二上学期期末考试化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题新疆维吾尔自治区北京大学附属中学新疆分校2018-2019学年高二下学期期中考试化学试题福建省长泰县第一中学2018-2019学年高二下学期期末考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题江苏省盐城市伍佑中学2019-2020学年高二下学期第一次阶段考试化学试题湖北省武汉市黄陂区第六中学2019-2020学年高二下学期三月线上考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题湖北省仙桃市汉江中学2018-2019学年高二下学期期中考试化学试题新疆新源县第二中学2019-2020学年高二下学期期末考试化学试题宁夏石嘴山市平罗中学2021-2022学年高二上学期期中考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题河北省保定高碑店市崇德实验中学2022-2023学年高三上学期10月月考化学试题江西省南昌市八一中学2022-2023学年高二上学期1月期末考试化学试题(已下线)第01讲 原子结构-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)第一章章节专项提升贵州省遵义市桐梓县荣兴高级中学2023-2024学年高二下学期第一次(3月)月考化学试题(已下线)2012届浙江省杭州高中高三第二次月考化学试卷(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)选择题6-10
名校
2 . 滴定是一种重要的定量实验方法:
Ⅰ.酸碱中和滴定:常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
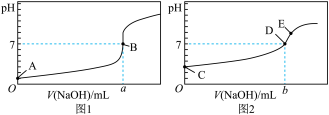
(1)滴定盐酸的曲线是图_______ (填“1”或“2”)
(2)达到B、D状态时,反应消耗的NaOH溶液的体积a_______ b(填“>”“<”或“=”)
Ⅱ.氧化还原滴定原理与中和滴定原理相似, 为了测定某草酸样品的纯度,进行如下实验:称取w g草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为a mol•L﹣1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应为:2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 +10CO2↑ + 2MnSO4 +8H2O。试回答:
(3)实验中,标准液KMnO4溶液应装在_______ 中。
(4)实验中眼睛注视锥形瓶内溶液颜色的变化,直至滴定终点。判断到达终点的现象是_____ 。
(5)若滴定开始和结束时,盛装KMnO4溶液的滴定管中的液面如图所示,则所用KMnO4溶液的体积为______ mL。以此计算出该草酸样品的纯度为____ 。(用“a”和“w”表示)

(6)实验中,下列操作(其它操作均正确),会使所测草酸浓度偏大的是____ 。
A.滴定前俯视刻度,滴定后仰视刻度
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分
Ⅰ.酸碱中和滴定:常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图
(2)达到B、D状态时,反应消耗的NaOH溶液的体积a
Ⅱ.氧化还原滴定原理与中和滴定原理相似, 为了测定某草酸样品的纯度,进行如下实验:称取w g草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为a mol•L﹣1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应为:2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 +10CO2↑ + 2MnSO4 +8H2O。试回答:
(3)实验中,标准液KMnO4溶液应装在
(4)实验中眼睛注视锥形瓶内溶液颜色的变化,直至滴定终点。判断到达终点的现象是
(5)若滴定开始和结束时,盛装KMnO4溶液的滴定管中的液面如图所示,则所用KMnO4溶液的体积为

(6)实验中,下列操作(其它操作均正确),会使所测草酸浓度偏大的是
A.滴定前俯视刻度,滴定后仰视刻度
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分
您最近一年使用:0次
名校
解题方法
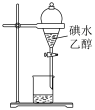
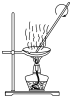
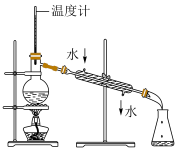
3 . 用下列实验装置进行的相应实验,能达到实验目的的是
 |  |  |  |
| 图1 | 图2 | 图3 | 图4 |
| A.图1所示装置可萃取碘水中的碘 |
| B.图2所示装置可测定反应过程中所放出的热量计算中和热 |
| C.图3所示装置蒸发MgCl2溶液得氯化镁晶体 |
| D.图4所示装置可分离两种互溶但沸点相差较大的液体混合物 |
您最近一年使用:0次
名校
4 . Ⅰ.高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下,请回答下列问题:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下,请回答下列问题:
(1)该反应的平衡常数表达式K=______ 。
(2)在一个容积为10 L的密闭容器中,1000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。CO的平衡转化率=_______ 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是____ (填字母序号)。
A.减少Fe的量 B.移出部分CO2 C.增加Fe2O3的量
D.减小容器的容积 E.提高反应温度 F.加入合适的催化剂
Ⅱ.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g) 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。

(4)该温度下,该反应的平衡常数为________ ,若温度升高,K值将______ (填“增大”、“减小”或“不变”)。
(5)a、b、c、d四个点中,表示化学反应处于平衡状态的是_______ 点。从起点开始首次达到平衡时,以NO2表示的反应速率υ(NO2)=_______ mol·L−1·min−1。
(6)25 min时,加入了______ (填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(7)25℃时,1.00 g N2H4(l) (联氨)与足量N2O4 (l)完全反应生成N2(g)和H2O (l)放出19.14 kJ的热量。则该反应的热化学方程式为:__________ 。
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下,请回答下列问题:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下,请回答下列问题:| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)在一个容积为10 L的密闭容器中,1000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。CO的平衡转化率=
(3)欲提高(2)中CO的平衡转化率,可采取的措施是
A.减少Fe的量 B.移出部分CO2 C.增加Fe2O3的量
D.减小容器的容积 E.提高反应温度 F.加入合适的催化剂
Ⅱ.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)
 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
(4)该温度下,该反应的平衡常数为
(5)a、b、c、d四个点中,表示化学反应处于平衡状态的是
(6)25 min时,加入了
(7)25℃时,1.00 g N2H4(l) (联氨)与足量N2O4 (l)完全反应生成N2(g)和H2O (l)放出19.14 kJ的热量。则该反应的热化学方程式为:
您最近一年使用:0次
名校
5 . K、Ka、KW分别表示化学平衡常数、电离平衡常数和水的离子积常数,下列判断正确的是
| A.温度升高,三者都增大 |
| B.化学平衡常数的大小与温度、浓度、催化剂等有关 |
| C.室温下Ka(HCN)<Ka(HF),说明HF的电离度比HCN大 |
D.2SO2(g)+O2(g) 2SO3(g)平衡后,仅增大压强,平衡向右移动,K值不变 2SO3(g)平衡后,仅增大压强,平衡向右移动,K值不变 |
您最近一年使用:0次
名校
解题方法
6 . 已知HF的酸性强于CH3COOH,常温下有下列三种溶液,有关叙述中不正确的是
| 编号 | ① | ② | ③ |
| pH | 11 | 3 | 3 |
| 溶液 | NaOH溶液 | CH3COOH溶液 | HF溶液 |
| A.②、③混合后: c(H+)=c(F-)+c(CH3COO-)+c(OH-) |
| B.①、②等体积混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.中和相同体积的②、③,需消耗相同体积的① |
| D.向③中加入CH3COONa固体,HF的电离平衡向右移动 |
您最近一年使用:0次
名校
解题方法
7 . 下列实验现象(或操作)与盐类水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
② 1 mol/L的醋酸加水稀释,溶液的pH增大,导电能力减弱
③用Al2(SO4)3与NaHCO3两种溶液作泡沫灭火剂
④ 配制FeCl3溶液时,将FeCl3固体溶解在浓盐酸中,再用水稀释到所需浓度
⑤氮肥NH4HCO3与钾肥K2CO3混施可能会降低肥效
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
② 1 mol/L的醋酸加水稀释,溶液的pH增大,导电能力减弱
③用Al2(SO4)3与NaHCO3两种溶液作泡沫灭火剂
④ 配制FeCl3溶液时,将FeCl3固体溶解在浓盐酸中,再用水稀释到所需浓度
⑤氮肥NH4HCO3与钾肥K2CO3混施可能会降低肥效
| A.①③④⑤ | B.①②③④ | C.①②④⑤ | D.②③④⑤ |
您最近一年使用:0次
名校
解题方法
8 . 用如图所示的装置电解K2SO4溶液同时制备H2SO4和KOH溶液,Ⅱ中装入K2SO4溶液,下列有关分析正确的是(a、b是离子交换膜)


| A.Ⅰ区生成H2SO4 | B.b是阳离子交换膜 |
| C.Ⅱ区中的K+进入Ⅰ区 | D.Ⅲ区溶液的pH会升高 |
您最近一年使用:0次
名校
解题方法
9 . 下列离子方程式书写正确的是
A.NaHCO3的电离:NaHCO3  Na+ + Na+ +  |
| B.铁与稀硝酸反应:Fe +2H+ = Fe 2+ + H2↑ |
C.AlCl3溶液与Na2S溶液反应:2Al3++ 3S2-+ 6H2O  2Al(OH)3 + 3H2S 2Al(OH)3 + 3H2S |
D.以Pt为电极材料电解AgNO3溶液:4Ag+ + 2H2O 4Ag + O2↑+ 4H+ 4Ag + O2↑+ 4H+ |
您最近一年使用:0次
名校
10 . 一定温度下,在恒容容器中,反应4NH3 (g)+5O2(g)  4NO(g)+6H2O(g)达到平衡的标志是
4NO(g)+6H2O(g)达到平衡的标志是
 4NO(g)+6H2O(g)达到平衡的标志是
4NO(g)+6H2O(g)达到平衡的标志是A.单位时间内每消耗0.25mol O2 ,同时生成0.3mol H2O  |
| B.混合气体的平均相对分子质量不再改变 |
| C.单位时间内断裂12 mol H−O键的同时生成12 mol N−H键 |
| D.混合气体的密度不发生变化 |
您最近一年使用:0次



