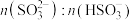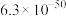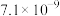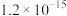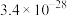名校
1 . 实验测得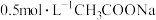 溶液、
溶液、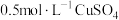 溶液以及
溶液以及 的pH随温度变化的曲线如图所示。下列说法正确的是
的pH随温度变化的曲线如图所示。下列说法正确的是

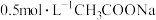 溶液、
溶液、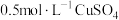 溶液以及
溶液以及 的pH随温度变化的曲线如图所示。下列说法正确的是
的pH随温度变化的曲线如图所示。下列说法正确的是
A.随温度升高,纯水中 |
B.随温度升高, 溶液的 溶液的 减小 减小 |
C.随温度升高, 溶液和 溶液和 溶液的pH均降低,是因为 溶液的pH均降低,是因为 、 、 水解平衡移动方向不同 水解平衡移动方向不同 |
D.温度升高至60℃, 溶液中由水电离出的 溶液中由水电离出的 是 是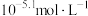 |
您最近一年使用:0次
名校
2 . 人体血液存在 (
( )与
)与 的缓冲体系,能有效除掉人体正常代谢时产生的少量酸、碱,保持pH的稳定,有关说法不正确的是
的缓冲体系,能有效除掉人体正常代谢时产生的少量酸、碱,保持pH的稳定,有关说法不正确的是
 (
( )与
)与 的缓冲体系,能有效除掉人体正常代谢时产生的少量酸、碱,保持pH的稳定,有关说法不正确的是
的缓冲体系,能有效除掉人体正常代谢时产生的少量酸、碱,保持pH的稳定,有关说法不正确的是A.代谢产生的 被 被 结合形成 结合形成 |
B.代谢产生的碱被 中和, 中和, 又由 又由 电离补充 电离补充 |
| C.血液中的缓冲体系可抵抗大量酸、碱的影响 |
D.人体出现酸中毒时可注射少量 溶液缓解 溶液缓解 |
您最近一年使用:0次
名校
解题方法
3 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.常温下,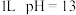 的 的 溶液中由水电离的 溶液中由水电离的 数目为 数目为 |
B.标准状况下,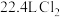 通入足量水中,所得溶液中 通入足量水中,所得溶液中 、HClO、 、HClO、 的个数和为 的个数和为 |
C.含 的 的 溶液中加入适量氨水使溶液呈中性,此时溶液中 溶液中加入适量氨水使溶液呈中性,此时溶液中 的数目为 的数目为 |
D. 酸性溶液中所含 酸性溶液中所含 的数目为 的数目为 |
您最近一年使用:0次
2024-01-20更新
|
72次组卷
|
2卷引用:湖南省长沙市第一中学2023-2024学年高二上学期第二次阶段性检测(12月)化学试题
名校
解题方法
4 . 盐的水解及沉淀的溶解平衡是中学化学研究的重点之一、回答下列问题:
(1)已知常温下甲酸( )的电离常数
)的电离常数 。
。
①写出 水解反应的离子方程式:
水解反应的离子方程式:______ ,往其溶液中加入下列物质,能促进 水解的是
水解的是______ (填字母)。
A. B.
B. C.
C. D.
D.
②常温下,向 溶液中滴入
溶液中滴入 的
的 溶液,溶液的
溶液,溶液的 变化曲线如图所示,d点溶液中
变化曲线如图所示,d点溶液中
______ (保留两位有效数字);b点溶液中:
____ (填“>”“<”或“=”) 。
。 ,向该溶液中加入氢氧化钠稀溶液除去
,向该溶液中加入氢氧化钠稀溶液除去 (
( 、
、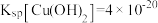 、
、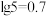 )
)
①常温下要使 降低为
降低为 ,溶液的
,溶液的 应调至
应调至_________ 。
②向 硫酸铜溶液中通入
硫酸铜溶液中通入 气体,该反应的离子方程式为
气体,该反应的离子方程式为___________ ,,当溶液中的 时,
时,
______  。
。
(3) 时,向
时,向 溶液中滴加
溶液中滴加 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的
浓度随加入的 体积的变化如图所示:
体积的变化如图所示:____ (填“增大”“不变”或“减小”)。
②若c点溶液中溶质的总物质的量为 ,向c点溶液中加入
,向c点溶液中加入 的
的 ,此时溶液满足的元素质量守恒式为
,此时溶液满足的元素质量守恒式为_________ 。
(1)已知常温下甲酸(
 )的电离常数
)的电离常数 。
。①写出
 水解反应的离子方程式:
水解反应的离子方程式: 水解的是
水解的是A.
 B.
B. C.
C. D.
D.
②常温下,向
 溶液中滴入
溶液中滴入 的
的 溶液,溶液的
溶液,溶液的 变化曲线如图所示,d点溶液中
变化曲线如图所示,d点溶液中

 。
。
 ,向该溶液中加入氢氧化钠稀溶液除去
,向该溶液中加入氢氧化钠稀溶液除去 (
( 、
、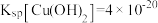 、
、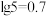 )
)①常温下要使
 降低为
降低为 ,溶液的
,溶液的 应调至
应调至②向
 硫酸铜溶液中通入
硫酸铜溶液中通入 气体,该反应的离子方程式为
气体,该反应的离子方程式为 时,
时,
 。
。(3)
 时,向
时,向 溶液中滴加
溶液中滴加 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的
浓度随加入的 体积的变化如图所示:
体积的变化如图所示:
②若c点溶液中溶质的总物质的量为
 ,向c点溶液中加入
,向c点溶液中加入 的
的 ,此时溶液满足的元素质量守恒式为
,此时溶液满足的元素质量守恒式为
您最近一年使用:0次
名校
解题方法
5 . 10℃时加热 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:
对于上述实验过程中的现象,甲同学和乙同学的观点如下:
(1)甲同学认为,最终该溶液的pH升高的原因是 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为______________________________ 。
(2)乙同学认为最终溶液pH升高的原因是 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为______________________________ ,并判断 的水解程度
的水解程度__________ (选填“>”或“<”) 。
。
关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________ (选填“甲”或“乙”)判断正确。试剂X是__________ 。
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
___________________________________________________________
(5) 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:
表中第__________ 组(选填序号)数据,可判断 溶液显
溶液显__________ (选填“酸”或“碱”)性。
 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,最终该溶液的pH升高的原因是
 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为(2)乙同学认为最终溶液pH升高的原因是
 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为 的水解程度
的水解程度 。
。关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
(5)
 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:9 |
pH | 8.2 | 7.2 | 6.2 |
 溶液显
溶液显
您最近一年使用:0次
解题方法
6 . NaClO在生产、生活中有广泛应用。某小组设计实验制备NaClO并探究其性质。回答下列问题:
实验(一)制备NaClO。实验装置如图所示(夹持仪器已省略)。

(1)装置B中试剂是_______ (填名称)
(2)写出装置A中发生反应的离子方程式:_______ 。
(3)研究发现,NaClO在热水中发生歧化反应生成NaCl和 ,已知:在水溶液中
,已知:在水溶液中 、
、 、
、 的相对能量依次为
的相对能量依次为 、
、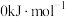 、
、 。写出该反应的热化学方程式:
。写出该反应的热化学方程式:_______ 。
实验(二)探究外界因素对NaClO水解程度的影响(在本题设定温度范围内NaClO只发生水解反应,不考虑其他副反应)。
【提出猜想】
猜想1:其他条件相同,pH越大,NaClO水解程度越小;
猜想2:其他条件相同,浓度越小,NaClO水解程度越大;
猜想3:其他条件相同,适当升温,NaClO水解程度增大。
【设计实验】
实验方案如下(各溶液浓度均为 ,每支试管各滴加3滴相同浓度的紫色石蕊溶液):
,每支试管各滴加3滴相同浓度的紫色石蕊溶液):
(4)实验1、3、4测得结果: ,用平衡移动原理解释实验结果:
,用平衡移动原理解释实验结果:_______ ;实验1、2不能验证猜想2,其原因是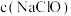 浓度越小,NaClO水解程度越大,而
浓度越小,NaClO水解程度越大,而 越小。请你提出改进方案:
越小。请你提出改进方案:_______ [已知NaClO水解度 ]。
]。
(5)实验结果; ,但是,不能证明猜想3成立,其原因是
,但是,不能证明猜想3成立,其原因是_______ 。
(6)经过小组讨论,大家认为可以通过测定不同温度下NaClO水解常数 ,确定温度对NaClO水解程度的影响。
,确定温度对NaClO水解程度的影响。
查阅资料: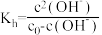 ,
, 为溶液起始浓度。
为溶液起始浓度。
试剂与仪器:一定浓度的NaClO溶液、 的盐酸、pH计等。
的盐酸、pH计等。
实验:测定30℃下NaClO水解常数 ,完成表中实验。
,完成表中实验。
分别在35℃、40℃下重复上述实验。
①实验8的实验内容是_______ 。
②数据处理:30℃,
_______ (用含a、b、V的代数式表示),
③实验结论: ,升温能促进NaClO水解。
,升温能促进NaClO水解。
实验(一)制备NaClO。实验装置如图所示(夹持仪器已省略)。

(1)装置B中试剂是
(2)写出装置A中发生反应的离子方程式:
(3)研究发现,NaClO在热水中发生歧化反应生成NaCl和
 ,已知:在水溶液中
,已知:在水溶液中 、
、 、
、 的相对能量依次为
的相对能量依次为 、
、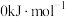 、
、 。写出该反应的热化学方程式:
。写出该反应的热化学方程式:实验(二)探究外界因素对NaClO水解程度的影响(在本题设定温度范围内NaClO只发生水解反应,不考虑其他副反应)。
【提出猜想】
猜想1:其他条件相同,pH越大,NaClO水解程度越小;
猜想2:其他条件相同,浓度越小,NaClO水解程度越大;
猜想3:其他条件相同,适当升温,NaClO水解程度增大。
【设计实验】
实验方案如下(各溶液浓度均为
 ,每支试管各滴加3滴相同浓度的紫色石蕊溶液):
,每支试管各滴加3滴相同浓度的紫色石蕊溶液):| 序号 | 温度/℃ | V(NaClO溶液)/mL | V(NaOH溶液)/mL | V(HCl溶液)/mL | V( )/mL )/mL | 褪色时间/s |
| 1 | 20 | 10.0 | 0 | 0 | 5.0 |  |
| 2 | 20 | 5.0 | 0 | 0 | 10.0 |  |
| 3 | 20 | 10.0 | 2.0 | 0 | 3.0 |  |
| 4 | 20 | 10.0 | 0 | 2.0 | 3.0 | 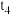 |
| 5 | 30 | 10.0 | 0 | 0 | 5.0 |  |
(4)实验1、3、4测得结果:
 ,用平衡移动原理解释实验结果:
,用平衡移动原理解释实验结果: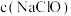 浓度越小,NaClO水解程度越大,而
浓度越小,NaClO水解程度越大,而 越小。请你提出改进方案:
越小。请你提出改进方案: ]。
]。(5)实验结果;
 ,但是,不能证明猜想3成立,其原因是
,但是,不能证明猜想3成立,其原因是(6)经过小组讨论,大家认为可以通过测定不同温度下NaClO水解常数
 ,确定温度对NaClO水解程度的影响。
,确定温度对NaClO水解程度的影响。查阅资料:
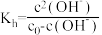 ,
, 为溶液起始浓度。
为溶液起始浓度。试剂与仪器:一定浓度的NaClO溶液、
 的盐酸、pH计等。
的盐酸、pH计等。实验:测定30℃下NaClO水解常数
 ,完成表中实验。
,完成表中实验。| 序号 | 实验内容 | 记录数据 |
| 6 | 取20.00mLNaClO溶液,用 盐酸滴定至终点 盐酸滴定至终点 | 消耗盐酸体积为VmL |
| 7 | 测得30℃纯水的pH | a |
| 8 | _______ | b |
①实验8的实验内容是
②数据处理:30℃,

③实验结论:
 ,升温能促进NaClO水解。
,升温能促进NaClO水解。
您最近一年使用:0次
名校
解题方法
7 . 漂白粉在溶液中存在平衡: ,下列措施能增强漂白能力是
,下列措施能增强漂白能力是
 ,下列措施能增强漂白能力是
,下列措施能增强漂白能力是A.加 稀释 稀释 | B.加少量纯碱 | C.通入 | D.滴加适量食醋 |
您最近一年使用:0次
名校
8 . 酸碱盐等电解质溶液中存在的电离平衡、水解平衡和沉淀溶解平衡都与生命活动、日常生活、工农业生产和环境保护等息息相关。请回答下列问题:
(1)在0.1mol/L的重铬酸钾( )溶液中存在如下平衡:
)溶液中存在如下平衡: 。在强碱溶液中,+6价铬元素的主要存在形式为
。在强碱溶液中,+6价铬元素的主要存在形式为______ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中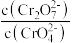 将
将______ (填“增大”“减小”或“不变”)。
(2)①NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品。相同条件下,0.1mol·L-1 NH4Al(SO4)2中c(NH )
)______ 0.1mol·L-1NH4HSO4中c(NH )。(填“>”“<”或“=”);
)。(填“>”“<”或“=”);
②25℃时,测得某浓度 NH4Al(SO4)2溶液的pH=3.2,其中2c(SO )-c(NH
)-c(NH )-3c(Al3+)
)-3c(Al3+)_____ mol·L-1。(不必化简,用代数式表示)
(3)重金属离子对河流、海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子其浓度各约为0.01mol/L。排放前拟用沉淀法除去这两种离子,查找有关数据如下(常温):
①认为往废水中投入___________ (填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
②常温下,如果用生石灰处理上述废水,使溶液的pH=9.0,处理后的废水中c(Pb2+)=___________ 。
(1)在0.1mol/L的重铬酸钾(
 )溶液中存在如下平衡:
)溶液中存在如下平衡: 。在强碱溶液中,+6价铬元素的主要存在形式为
。在强碱溶液中,+6价铬元素的主要存在形式为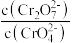 将
将(2)①NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品。相同条件下,0.1mol·L-1 NH4Al(SO4)2中c(NH
 )
) )。(填“>”“<”或“=”);
)。(填“>”“<”或“=”);②25℃时,测得某浓度 NH4Al(SO4)2溶液的pH=3.2,其中2c(SO
 )-c(NH
)-c(NH )-3c(Al3+)
)-3c(Al3+)(3)重金属离子对河流、海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子其浓度各约为0.01mol/L。排放前拟用沉淀法除去这两种离子,查找有关数据如下(常温):
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp |
|
|
|
|
|
|
A.NaOH B.Na2S C.KI D.Ca(OH)2
②常温下,如果用生石灰处理上述废水,使溶液的pH=9.0,处理后的废水中c(Pb2+)=
您最近一年使用:0次
名校
9 . 在含有弱电解质的溶液中,往往有多个平衡共存。
(1)常温下,将 的某一元酸
的某一元酸 溶液和
溶液和 的
的 溶液等体积混合后溶液的
溶液等体积混合后溶液的 大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是___________ (填字母)。
A.
B.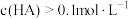
C.
(2)常温下,向 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳元素的各种微粒(
溶液,溶液中含碳元素的各种微粒( 因逸出未画出)的物质的量分数(纵轴)随溶液的
因逸出未画出)的物质的量分数(纵轴)随溶液的 变化的部分情况如图所示。
变化的部分情况如图所示。

①在同一溶液中,
___________ (填“能”或“不能”)大量共存。
②当 时,溶液中
时,溶液中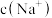
___________ (填“>”、“<”或“=”)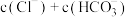 。
。
③ 时,
时, 水解反应的平衡常数
水解反应的平衡常数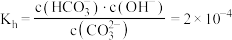 ,当溶液中
,当溶液中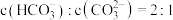 时,溶液的
时,溶液的
___________ 。
(3) 虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。
① 在溶液中分三步水解:
在溶液中分三步水解:


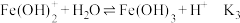
上述水解反应的平衡常数 由大到小的顺序是
由大到小的顺序是___________ 。
②通过控制条件,上述水獬产物聚合,生成聚合氯化铁,其离子方程式为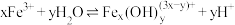 ,欲使平衡正向移动可采用的措施是
,欲使平衡正向移动可采用的措施是___________ (填字母)。
a.加水稀释 b.降温 c.加入
(1)常温下,将
 的某一元酸
的某一元酸 溶液和
溶液和 的
的 溶液等体积混合后溶液的
溶液等体积混合后溶液的 大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是A.

B.
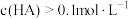
C.

(2)常温下,向
 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳元素的各种微粒(
溶液,溶液中含碳元素的各种微粒( 因逸出未画出)的物质的量分数(纵轴)随溶液的
因逸出未画出)的物质的量分数(纵轴)随溶液的 变化的部分情况如图所示。
变化的部分情况如图所示。
①在同一溶液中,

②当
 时,溶液中
时,溶液中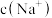
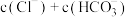 。
。③
 时,
时, 水解反应的平衡常数
水解反应的平衡常数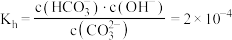 ,当溶液中
,当溶液中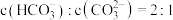 时,溶液的
时,溶液的
(3)
 虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。①
 在溶液中分三步水解:
在溶液中分三步水解:

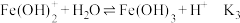
上述水解反应的平衡常数
 由大到小的顺序是
由大到小的顺序是②通过控制条件,上述水獬产物聚合,生成聚合氯化铁,其离子方程式为
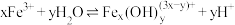 ,欲使平衡正向移动可采用的措施是
,欲使平衡正向移动可采用的措施是a.加水稀释 b.降温 c.加入

您最近一年使用:0次
名校
10 . 一定温度下,稀释 的
的 溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
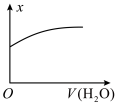
 的
的 溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
A. 水解的平衡常数 水解的平衡常数 | B. |
C. | D. |
您最近一年使用:0次