1 . CO2的回收和资源化对于实现“碳中和”具有重要意义。
(1)CH4与CO2重整生成H2和CO的反应为CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH=+247.6kJ•mol-1
①已知H2(g)和CO(g)的燃烧热分别为285.8kJ•mol-1和283.0kJ•mol-1.则CH4的燃烧热为_______ 。
②CH4与CO2重整过程中还发生反应H2(g)+CO2(g)=H2O(g)+CO(g)ΔH=+41.2kJ•mol-1。在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。
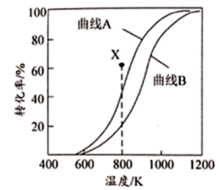
I.曲线_______ (填“A”或“B”)表示CH4的平衡转化率随温度的变化。
Ⅱ.800K、起始n(CH4):n(CO2)=1:1条件下,要让CH4平衡转化率达到X点的值,可以采取的措施是_______ (过程中不充入或分离出任何物质)。
(2)M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
①H2A为_______ 酸(填“强”或“弱”),往H2A溶液中加水会使 的值
的值_______ (填“增大”、“减小”或“不变”)。
②往Na2A溶液中加入_______ 可抑制其水解(选填字母序号)。
a.浓盐酸 b.KOH固体 c.水 d.升高温度
③浓度均为0.1mol·L-1的Na2A、NaHA混合溶液中: =
=_______ 。
(1)CH4与CO2重整生成H2和CO的反应为CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH=+247.6kJ•mol-1
①已知H2(g)和CO(g)的燃烧热分别为285.8kJ•mol-1和283.0kJ•mol-1.则CH4的燃烧热为
②CH4与CO2重整过程中还发生反应H2(g)+CO2(g)=H2O(g)+CO(g)ΔH=+41.2kJ•mol-1。在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。

I.曲线
Ⅱ.800K、起始n(CH4):n(CO2)=1:1条件下,要让CH4平衡转化率达到X点的值,可以采取的措施是
(2)M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
①H2A为
 的值
的值②往Na2A溶液中加入
a.浓盐酸 b.KOH固体 c.水 d.升高温度
③浓度均为0.1mol·L-1的Na2A、NaHA混合溶液中:
 =
=
您最近一年使用:0次
名校
2 . 实验是化学研究的重要手段,下列有关实验装置能达到实验目的的是
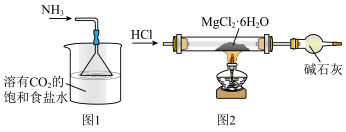
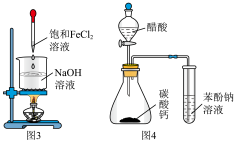


A.图1装置制备大量 | B.图2装置制备无水 |
C.图3装置制备 胶体 胶体 | D.图4装置可比较醋酸、碳酸、苯酚酸性强弱 |
您最近一年使用:0次
2023-05-04更新
|
426次组卷
|
3卷引用:新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题
名校
解题方法
3 . 有研究认为,在强碱性溶液中,反应 分三步进行
分三步进行
①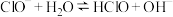 ,
,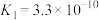
②……
③ ,
,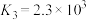
下列说法错误的是
 分三步进行
分三步进行①
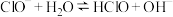 ,
,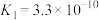
②……
③
 ,
,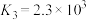
下列说法错误的是
A.氧化性: |
B.升温, 增大 增大 |
C.第②步反应: |
D. ,故反应速率:③>① ,故反应速率:③>① |
您最近一年使用:0次
2023-03-31更新
|
146次组卷
|
2卷引用:新疆生产建设兵团第二中学2023-2024学年高三上学期12月月考化学题
4 . 在Al3++3H2O A1(OH)3+3H+的平衡体系中,要促进Al3+的水解,可采取的措施
A1(OH)3+3H+的平衡体系中,要促进Al3+的水解,可采取的措施
 A1(OH)3+3H+的平衡体系中,要促进Al3+的水解,可采取的措施
A1(OH)3+3H+的平衡体系中,要促进Al3+的水解,可采取的措施| A.降低温度 | B.滴加少量盐酸 | C.加入适量氢氧化钠溶液 | D.加少量氯化钠固体 |
您最近一年使用:0次
2022-10-04更新
|
629次组卷
|
5卷引用:新疆阿勒泰地区2022-2023学年高二上学期期末联考化学试题
5 . 温度一定时,为了使 Na2S 溶液中的比值  变小,可采取的措施是
变小,可采取的措施是
 变小,可采取的措施是
变小,可采取的措施是| A.加热 | B.加适量 NaOH(s) | C.加水 | D.加适量 KHS(s) |
您最近一年使用:0次
2022-04-14更新
|
860次组卷
|
4卷引用:新疆伊犁新源县2021-2022学年高二上学期期末考试化学试题
名校
6 . 常温下,浓度为0.1mol·L-1的四种溶液pH如表,下列说法中正确的是
| 溶液 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 8.3 | 10.7 | 4.0 |
| A.0.1mol·L-1Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减小 |
B.NaHCO3溶液中2c(H2CO3)+c(H+)=c(OH-)+c(CO ) ) |
C.NaHSO3溶液中c(Na+)>c(HSO )>c(H2SO3)>c(SO )>c(H2SO3)>c(SO )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
D.向NaClO溶液中滴加硫酸至中性时,c(Na+)=2c(SO )+c(ClO-) )+c(ClO-) |
您最近一年使用:0次
2021-11-08更新
|
405次组卷
|
4卷引用:新疆昌吉州2021-2022学年高二上学期期末考试化学试题
解题方法
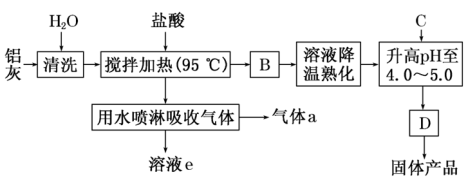
7 . 聚合氯化铝晶体是介于AlCl3和Al(OH)3 之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:___________ (用化学式表示)。
(2)升高pH至4.0~5.0的目的是___________ 。
(3)生产过程中可循环使用的物质是___________ (用化学式表示)。
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用___________ (填编号)。
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[Al2(OH)nCl6-n·xH2O]m,
①称取a g晶体,制成粉末,加热至质量不再变化为止,称量为b g。此过程可能用到的下列仪器有___________ 。
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作:用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为c g。A试剂为___________ (填试剂名称),C操作为___________ (填操作名称)
(2)升高pH至4.0~5.0的目的是
(3)生产过程中可循环使用的物质是
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[Al2(OH)nCl6-n·xH2O]m,
①称取a g晶体,制成粉末,加热至质量不再变化为止,称量为b g。此过程可能用到的下列仪器有
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作:用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为c g。A试剂为
您最近一年使用:0次
2021-10-22更新
|
182次组卷
|
3卷引用:新疆哈密市第十五中学2021-2022学年高三上学期第一次月考化学试题
2021高三·全国·专题练习
名校
8 . 常温下,滴有两滴酚酞溶液的Na2CO3溶液中存在CO +H2O⇌HCO
+H2O⇌HCO +OH-平衡,溶液呈红色,下列说法不正确的是
+OH-平衡,溶液呈红色,下列说法不正确的是
 +H2O⇌HCO
+H2O⇌HCO +OH-平衡,溶液呈红色,下列说法不正确的是
+OH-平衡,溶液呈红色,下列说法不正确的是A.稀释溶液, 增大 增大 |
| B.通入CO2,或者加入少量氯化铵溶液,溶液pH均减小 |
| C.升高温度,红色变深,平衡常数增大 |
D.加入NaOH固体,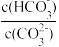 减小 减小 |
您最近一年使用:0次
2021-09-05更新
|
1393次组卷
|
8卷引用:新疆乌鲁木齐市第一中学2022-2023学年高二上学期期中考试化学试题
新疆乌鲁木齐市第一中学2022-2023学年高二上学期期中考试化学试题(已下线)课时42 盐类的水解影响因素及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第三章第三节 盐类的水解(第1课时 盐类的水解)(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)专题26 盐类的水解(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)2021年广东省高考化学试卷变式题1-10题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(广东专用)陕西省/渭南市蒲城县尧山中学2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
9 . 在一定条件下,Na2CO3溶液存在水解平衡: +H2O
+H2O
 +OH-。下列说法正确的是
+OH-。下列说法正确的是
 +H2O
+H2O
 +OH-。下列说法正确的是
+OH-。下列说法正确的是| A.稀释溶液,平衡右移,碱性增强 | B.通入CO2,平衡朝正反应方向移动 |
C.升高温度,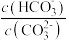 减小 减小 | D.加入NaOH固体,溶液pH减小 |
您最近一年使用:0次
2021-04-23更新
|
252次组卷
|
3卷引用:新疆乌苏市第一中学2021-2022学年高二12月月考化学试题
名校
10 . 已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,pH 相同的三种溶液①NaF 溶液 ②NaClO 溶液 ③Na2CO3 溶液,其物质的量溶度由大到小的顺序是_______ (填序号)
(2)25°C 时,pH=4 的 NH4Cl 溶液中各离子浓度的大小关系为_______ 。
(3)0.1 mol/L 的 NaClO 溶液和 0.1 mol/L 的 NaHCO3 溶液中,c(ClO- )_______ c(HCO )(填“>,<,=”)
)(填“>,<,=”)
(4)向 NaClO 溶液中通入少量的 CO2,所发生的离子方程式为_______ 。
| 化学式 | HF | HClO | H2CO3 | NH3∙H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1 =4.3×10-7 K2 =5.6×10-11 | Kb =1.7×10-5 |
(1)常温下,pH 相同的三种溶液①NaF 溶液 ②NaClO 溶液 ③Na2CO3 溶液,其物质的量溶度由大到小的顺序是
(2)25°C 时,pH=4 的 NH4Cl 溶液中各离子浓度的大小关系为
(3)0.1 mol/L 的 NaClO 溶液和 0.1 mol/L 的 NaHCO3 溶液中,c(ClO- )
 )(填“>,<,=”)
)(填“>,<,=”)(4)向 NaClO 溶液中通入少量的 CO2,所发生的离子方程式为
您最近一年使用:0次



