解题方法
1 . 向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c_ >c_____ >c_____ >c_____
②当盐酸与氨水等物质的量反应时,溶液的pH_____ 7(填“>”或“<”或“=”,下同).
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为: n(NH3·H2O)___ n(HCl),溶液中c( NH4+)_______ c(Cl﹣).
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c
②当盐酸与氨水等物质的量反应时,溶液的pH
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为: n(NH3·H2O)
您最近一年使用:0次
13-14高二上·江西宜春·期末
2 . 下列关于电解质溶液的叙述正确的是
| A.室温下,pH=3的氢氟酸加水稀释后,电离常数Ka(HF)和pH均减小 |
| B.室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
C.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中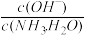 增大 增大 |
| D.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
您最近一年使用:0次
9-10高二下·广东中山·阶段练习
解题方法
3 . 常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中
| A.c(NH4+)<c(Cl-) | B.c(NH4+)=c(Cl-) |
| C.c(NH4+)>c(Cl-) | D.无法确定c(NH4+)与c(Cl-)的关系 |
您最近一年使用:0次
2016-12-09更新
|
999次组卷
|
8卷引用:2010年江西省德兴市四校联考高二上学期期中考试化学试卷
(已下线)2010年江西省德兴市四校联考高二上学期期中考试化学试卷(已下线)09~10学年中山一中高二下学期第三次段考(已下线)2010年北京五中高二下学期期末考试化学试题(已下线)2010年四川省成都市实验中学高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷(已下线)2011-2012学年安徽省六安三中高二上学期期末考试化学A卷2016-2017学年陕西西藏民族学院附中高二上月考二化学卷甘肃省武威市第十八中学2018-2019学年高二上学期期末考试化学试题
11-12高一上·江西南昌·期中
4 . 下列叙述正确的是
| A.CH4的摩尔质量为16g | B.CaCl2溶液中:C(Ca2+)+C(H+)=C(Cl-)+C(OH-) |
| C.3.01×1023个SO2分子的质量为32g | D.相同质量的SO2和SO3,分子数之比为1∶1 |
您最近一年使用:0次
13-14高一上·甘肃兰州·期末
名校
解题方法
5 . 在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,加入等体积0.3 mol/L的BaCl2溶液恰好使SO42-完全沉淀,则原混合溶液中Na+的浓度为
| A.0.3mol/L | B.0.45mol/L | C.0.6mol/L | D.0.15mol/L |
您最近一年使用:0次
2016-11-09更新
|
159次组卷
|
14卷引用:2016-2017学年江西省玉山一中高一上第一次月考化学卷
2016-2017学年江西省玉山一中高一上第一次月考化学卷2016-2017学年江西省南昌二中高一上月考一化学试卷(已下线)2012-2013学年甘肃省兰州一中高一上学期期末考试化学试卷2014-2015江苏省南通中学高一上学期期末化学试卷2015-2016学年安徽省合肥168中高一上学期期末化学试卷河北省鸡泽县第一中学2016-2017学年高二下学期期末考试化学试题贵州省思南中学2017-2018学年高一上学期第一次月考化学试题湖北省荆州市荆州中学2017-2018学年高一上学期第一次月考化学试题四川省南充市阆中中学2020-2021学年高一上学期期中考试化学试题甘肃省民勤县第一中学2020-2021学年高一上学期第一次月考化学试题四川省南充市高级中学2020-2021学年高一上学期期中考试化学试题广西北流市实验中学2020-2021学年高一上学期期中考试化学试题四川省南充高级中学2017-2018学年高一上学期期中考试化学试题四川省南充市白塔中学2021-2022学年高一上学期期中考试化学试题
10-11高二·江西南昌·阶段练习
6 . 20℃时,醋酸的电离平衡常数为1.6×10-5。
(1)试计算20℃时0.01mol•L-1的醋酸溶液中氢离子浓度为______ ;
(2)室温时,向0.2mol•L-1的醋酸溶液中加入等体积的0.1mol•L-1的NaOH(aq),充分反应后所得溶液的PH=4,则:
①所得溶液中各离子(包括CH3COOH分子)浓度大小关系是:______________________ ,
②所得溶液中的物料守恒式为:________ +________ =__________ =_________ mol•L-1。
③c(CH3COOH)=_____________ mol•L-1(写出算式,不做近似计算)
(1)试计算20℃时0.01mol•L-1的醋酸溶液中氢离子浓度为
(2)室温时,向0.2mol•L-1的醋酸溶液中加入等体积的0.1mol•L-1的NaOH(aq),充分反应后所得溶液的PH=4,则:
①所得溶液中各离子(包括CH3COOH分子)浓度大小关系是:
②所得溶液中的物料守恒式为:
③c(CH3COOH)=
您最近一年使用:0次



