1 . Ⅰ.已知25℃时部分弱电解质的电离平衡常数如下表所示,请回答下列问题:
(1)25℃时 溶液显
溶液显___________ (填“酸性”、“碱性”或“中性”)。
(2)25℃时物质的量浓度均为0.1mol/L的 、NaClO、
、NaClO、 三种溶液中pH最小的是
三种溶液中pH最小的是___________ (填化学式)。
(3)常温下,向HCN溶液中加入等体积、等浓度的NaCN溶液,所得混合溶液中所有离子的浓度由大到小的顺序为___________ 。
(4)25℃时,向 溶液中加入NaOH固体到pH=7,则
溶液中加入NaOH固体到pH=7,则
___________ 。
Ⅱ.某科研单位利用NO-空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:

(5)①Pt(Ⅰ)电极上发生的电极反应式为___________ 。
②X膜为___________ 离子交换膜(填“阴”或“阳”)。
③理论上,若Pt(Ⅱ)电极上参加反应的NO在标况下的体积为4.48L,则Cr棒增重___________ g。
| 化学式 |  |  |  |  |  |
| 电离常数 |  |  |  |  |   |
(1)25℃时
 溶液显
溶液显(2)25℃时物质的量浓度均为0.1mol/L的
 、NaClO、
、NaClO、 三种溶液中pH最小的是
三种溶液中pH最小的是(3)常温下,向HCN溶液中加入等体积、等浓度的NaCN溶液,所得混合溶液中所有离子的浓度由大到小的顺序为
(4)25℃时,向
 溶液中加入NaOH固体到pH=7,则
溶液中加入NaOH固体到pH=7,则
Ⅱ.某科研单位利用NO-空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:

(5)①Pt(Ⅰ)电极上发生的电极反应式为
②X膜为
③理论上,若Pt(Ⅱ)电极上参加反应的NO在标况下的体积为4.48L,则Cr棒增重
您最近一年使用:0次
名校
解题方法
2 . 食醋是烹饪美食的调味品,有效成分主要为醋酸. 的应用与其电离平衡密切相关.25℃时,
的应用与其电离平衡密切相关.25℃时, 的
的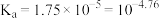 ;
;
(1)用化学用语表示 溶液呈碱性的原因
溶液呈碱性的原因__________________ (用离子方程式表示);
(2)下列方法中,可以使醋酸溶液中 电离程度增大的是___________;
电离程度增大的是___________;
(3)用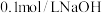 溶液分别滴定体积均为20mL、浓度均为
溶液分别滴定体积均为20mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入
的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入 溶液体积而变化的两条滴定曲线;
溶液体积而变化的两条滴定曲线;
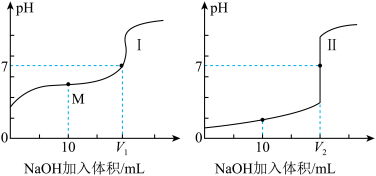
①滴定醋酸的曲线是____________ (填“Ⅰ”或“Ⅱ”);
②在上述滴定过程中,不需要使用的玻璃仪器是___________ (填序号);
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
③图1中M点,溶液中各离子浓度由大到小的顺序是___________ (用符号“c”及“>”表示),此时溶液中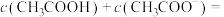
____________ ;(精确到小数点后三位数字)
(4)用 的盐酸滴定20.00mL未知浓度的
的盐酸滴定20.00mL未知浓度的 溶液.下列操作会使测定结果偏低的是___________;
溶液.下列操作会使测定结果偏低的是___________;
 的应用与其电离平衡密切相关.25℃时,
的应用与其电离平衡密切相关.25℃时, 的
的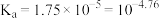 ;
;(1)用化学用语表示
 溶液呈碱性的原因
溶液呈碱性的原因(2)下列方法中,可以使醋酸溶液中
 电离程度增大的是___________;
电离程度增大的是___________;| A.滴加少量浓盐酸 | B.微热溶液 | C.加水稀释 | D.加入少量醋酸钠晶体 |
(3)用
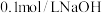 溶液分别滴定体积均为20mL、浓度均为
溶液分别滴定体积均为20mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入
的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入 溶液体积而变化的两条滴定曲线;
溶液体积而变化的两条滴定曲线;
①滴定醋酸的曲线是
②在上述滴定过程中,不需要使用的玻璃仪器是
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
③图1中M点,溶液中各离子浓度由大到小的顺序是
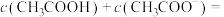
(4)用
 的盐酸滴定20.00mL未知浓度的
的盐酸滴定20.00mL未知浓度的 溶液.下列操作会使测定结果偏低的是___________;
溶液.下列操作会使测定结果偏低的是___________;A.量取 溶液的碱式滴定管未用待测碱液润洗 溶液的碱式滴定管未用待测碱液润洗 |
| B.酸式滴定管未用标准盐酸润洗 |
| C.滴定过程中滴定管内不慎有标准液溅出 |
| D.滴定前俯视读数,滴定后读数正确 |
您最近一年使用:0次
名校
3 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A. 水溶液中含有氧原子数为 水溶液中含有氧原子数为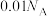 |
B.48g正丁烷和10g异丁烷的混合物中含有σ键数目为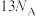 |
C.常温下, 的 的 溶液中,水电离出的 溶液中,水电离出的 数为 数为 |
D.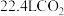 与足量NaOH溶液完全反应,则 与足量NaOH溶液完全反应,则 |
您最近一年使用:0次
2023-11-26更新
|
305次组卷
|
3卷引用:江西省宜春市上高二中2023-2024学年高二下学期3月月考化学试题
江西省宜春市上高二中2023-2024学年高二下学期3月月考化学试题 浙江省9+1高中联盟2023-2024学年高三上学期期中考试化学试题 (已下线)专题01 基本概念(5大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
名校
4 . 常温下,向100mL HTcO4(高锝酸)溶液中逐滴加入
HTcO4(高锝酸)溶液中逐滴加入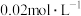 的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法
的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法错误 的是
 HTcO4(高锝酸)溶液中逐滴加入
HTcO4(高锝酸)溶液中逐滴加入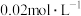 的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法
的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法
| A.HTcO4为强酸 |
| B.常温下,一定浓度的MTcO4稀溶液的pH>7 |
C.K点所对应的溶液中离子浓度的大小关系: |
D.K点对应的溶液中, |
您最近一年使用:0次
2023-09-15更新
|
300次组卷
|
2卷引用:江西省贵溪市实验中学2023-2024学年高三下学期4月第二次月考化学试卷
名校
5 . 平衡思想是化学研究一个重要观念。电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①常温下,物质的量浓度相同的三种溶液a、 b、
b、 c、
c、 ,pH由大到小的顺序是
,pH由大到小的顺序是_______ (填编号)。
②室温下, 溶液
溶液 ,用离子方程式表示溶液呈碱性的原因是
,用离子方程式表示溶液呈碱性的原因是_______ ,溶液中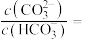
_______ 。
③向 溶液通入少量
溶液通入少量 ,离子方程式为
,离子方程式为_______ 。
(2) 属于酸性氧化物,将其通入
属于酸性氧化物,将其通入 溶液中,得到
溶液中,得到 溶液。
溶液。
① 溶液呈酸性,其原因是
溶液呈酸性,其原因是_______
②向 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,pH降为2,用平衡移动原理解释溶液pH降低的原因是
溶液,溶液中出现浑浊,pH降为2,用平衡移动原理解释溶液pH降低的原因是_______ 。
(3)某溶液是由体积相等的 溶液和醋酸混合而成,且恰好呈中性,则混合前
溶液和醋酸混合而成,且恰好呈中性,则混合前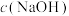
_______ 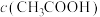 ,混合后溶液中
,混合后溶液中
_______  (填写“大于”、“等于”或者“小于”。)
(填写“大于”、“等于”或者“小于”。)
(1)已知部分弱酸的电离常数如下表:
| 弱酸 |  |  |  |
| 电离常数(25℃) |  |  |  , , |
 b、
b、 c、
c、 ,pH由大到小的顺序是
,pH由大到小的顺序是②室温下,
 溶液
溶液 ,用离子方程式表示溶液呈碱性的原因是
,用离子方程式表示溶液呈碱性的原因是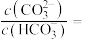
③向
 溶液通入少量
溶液通入少量 ,离子方程式为
,离子方程式为(2)
 属于酸性氧化物,将其通入
属于酸性氧化物,将其通入 溶液中,得到
溶液中,得到 溶液。
溶液。①
 溶液呈酸性,其原因是
溶液呈酸性,其原因是②向
 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,pH降为2,用平衡移动原理解释溶液pH降低的原因是
溶液,溶液中出现浑浊,pH降为2,用平衡移动原理解释溶液pH降低的原因是(3)某溶液是由体积相等的
 溶液和醋酸混合而成,且恰好呈中性,则混合前
溶液和醋酸混合而成,且恰好呈中性,则混合前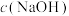
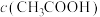 ,混合后溶液中
,混合后溶液中
 (填写“大于”、“等于”或者“小于”。)
(填写“大于”、“等于”或者“小于”。)
您最近一年使用:0次
2023-09-15更新
|
661次组卷
|
4卷引用:江西省南昌十九中2023-2024学年高二上学期期中考试化学试卷
名校
6 .  时,向
时,向 溶液中逐滴滴加
溶液中逐滴滴加 的盐酸,其
的盐酸,其 变化曲线如图所示。下列溶液中的关系一定正确的是(忽略体积微小变化)
变化曲线如图所示。下列溶液中的关系一定正确的是(忽略体积微小变化)

 时,向
时,向 溶液中逐滴滴加
溶液中逐滴滴加 的盐酸,其
的盐酸,其 变化曲线如图所示。下列溶液中的关系一定正确的是(忽略体积微小变化)
变化曲线如图所示。下列溶液中的关系一定正确的是(忽略体积微小变化)
| A.a、b、c三点水的电离程度最大的是c点 |
B. b点的溶液: |
C.c点的溶液: |
D.加入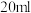 盐酸的溶液: 盐酸的溶液: |
您最近一年使用:0次
2023-07-30更新
|
291次组卷
|
4卷引用:江西省萍乡市2022-2023学年高二上学期1月期末考试化学试题
江西省萍乡市2022-2023学年高二上学期1月期末考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期10月月考化学试题(已下线)专题07 盐类水解-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期期末考试化学试卷
名校
7 . 下列水溶液一定呈中性的是
A. | B. 的醋酸和 的醋酸和 的氢氧化钠等体积混合后的溶液 的氢氧化钠等体积混合后的溶液 |
C. 的溶液 的溶液 | D. 的 的 溶液 溶液 |
您最近一年使用:0次
2023-07-30更新
|
172次组卷
|
2卷引用:江西省萍乡市2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
8 . 常温下a mol∙L−1稀氨水与b mol∙L−1稀盐酸等体积混合,下列判断一定正确的是
A.若a>b,则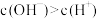 | B.若a>b,则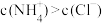 |
C.若a<b,则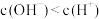 | D.若a=b,则 |
您最近一年使用:0次
2023-04-06更新
|
332次组卷
|
19卷引用:2014-2015学年江西省南昌二中高二上学期期中化学试卷
2014-2015学年江西省南昌二中高二上学期期中化学试卷2015-2016学年江西省铅山一中 、横峰中学高二上期中测试化学试卷(已下线)2013届上海市浦东新区高三下学期二模化学试卷(已下线)2015届甘肃省兰州一中高三9月月考化学试卷2015届广西玉林市博白县高三下学期返校调研考试化学试卷2014-2015河北省唐山市一中高二下学期开学调研化学试卷2016-2017学年河北省涿鹿县涿鹿中学高二上调研三化学卷2018版化学(苏教版)高考总复习专题八题型冲关--电解质溶液中粒子浓度关系【全国百强校】福建省上杭县第一中学2018-2019学年高二上学期12月月考化学试题上海市同济大学第一附属中学2019—2020学年高三上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——溶液的酸碱性(强化练习)【懂做原理题】2020届高三化学选修4二轮专题练——溶液中微粒浓度大小比较分析【精编25题】(已下线)上海市浦东新区2013届高三4月高考预测(二模)化学试题上海市进才中学2021-2022学年高二上学期期中考试化学试题上海师范大学附属中学2022-2023学年高三上学期期中考试化学试题上海市崇明区2022~2023学年高三下学期二模测试化学试题(已下线)专题17 水溶液中的离子平衡(已下线)四川省遂宁中学2022-2023学年高二下学期期中考试化学试题上海市育才中学2022-2023学年高二下学期第二次教学质量检测(等级考)化学调研卷
名校
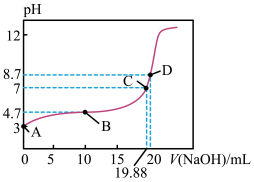
9 . 已知常温下,向20 mL 0.1000 mol/L  溶液中滴入0.1000 mol/L NaOH溶液,忽略温度变化,所得曲线如图所示。下列说法正确的是
溶液中滴入0.1000 mol/L NaOH溶液,忽略温度变化,所得曲线如图所示。下列说法正确的是
 溶液中滴入0.1000 mol/L NaOH溶液,忽略温度变化,所得曲线如图所示。下列说法正确的是
溶液中滴入0.1000 mol/L NaOH溶液,忽略温度变化,所得曲线如图所示。下列说法正确的是
| A.若A点pH=3.0,醋酸的电离度为10% |
B.若B点pH=4.7,该点电荷守恒式为 |
C.若C点加入NaOH溶液的体积为19.88 mL,离子浓度大小关系是 |
D.D点pH=8.7,溶液的物料守恒关系式是 |
您最近一年使用:0次
2023-02-16更新
|
242次组卷
|
4卷引用:江西省宜春市宜丰中学2023届高三模拟预测化学试题
10 . 根据水溶液中的离子平衡有关知识回答下列问题:
(1)纯水在100℃时, ,该温度下
,该温度下 的NaOH溶液中,由水电离出的
的NaOH溶液中,由水电离出的
_______  。
。
(2)常温下,将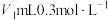 的稀盐酸与
的稀盐酸与 的NaOH溶液混合,所得溶液的pH为1,则
的NaOH溶液混合,所得溶液的pH为1,则
_______ (溶液体积变化忽略不计)。
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
①25℃时,等浓度的a:NaCN溶液、b: 溶液和c:
溶液和c: 溶液,三种溶液的pH由大到小的顺序为
溶液,三种溶液的pH由大到小的顺序为_______ 。(大小用a、b、c表示)
②向NaCN溶液中通入少量的 ,发生反应的化学方程式为
,发生反应的化学方程式为_______ 。
(4)常温下,用0.1000 mol∙L−1的NaOH溶液滴定20.00mL0.1000 mol∙L−1的 溶液,滴定过程中,溶液的pH与消耗NaOH溶液的体积的关系如图所示:
溶液,滴定过程中,溶液的pH与消耗NaOH溶液的体积的关系如图所示:

①该滴定过程应该选择_______ (填“酚酞”或“甲基橙”)作指示剂。
②a_______ 20mL(填“>”“<”或“=”)。
③C点溶液中离子浓度由大到小的顺序为_______ 。
(1)纯水在100℃时,
 ,该温度下
,该温度下 的NaOH溶液中,由水电离出的
的NaOH溶液中,由水电离出的
 。
。(2)常温下,将
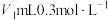 的稀盐酸与
的稀盐酸与 的NaOH溶液混合,所得溶液的pH为1,则
的NaOH溶液混合,所得溶液的pH为1,则
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN |  |
 |  |
 |  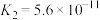 |
 溶液和c:
溶液和c: 溶液,三种溶液的pH由大到小的顺序为
溶液,三种溶液的pH由大到小的顺序为②向NaCN溶液中通入少量的
 ,发生反应的化学方程式为
,发生反应的化学方程式为(4)常温下,用0.1000 mol∙L−1的NaOH溶液滴定20.00mL0.1000 mol∙L−1的
 溶液,滴定过程中,溶液的pH与消耗NaOH溶液的体积的关系如图所示:
溶液,滴定过程中,溶液的pH与消耗NaOH溶液的体积的关系如图所示:
①该滴定过程应该选择
②a
③C点溶液中离子浓度由大到小的顺序为
您最近一年使用:0次



