解题方法
1 . 聚合硫酸铁简称聚铁[Fe2(OH)6-2n(SO4)n]m广泛用于饮用水等的净化。某化工厂利用硫酸铜废液制备聚铁,其流程如下:
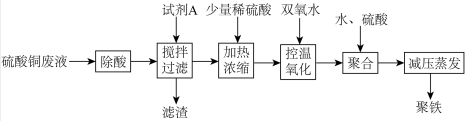
回答下列问题:
(1)试剂A为__________ 。
(2)本实验中两次加入硫酸,其中“加热浓缩“时加入稀硫酸,除了抑制离子水解,还为了_______ ,“聚合”时加硫酸是为了控制溶液的pH在一定范围内,若pH偏大,则_________ 。
(3)“控温氧化”时选用绿色氧化剂双氧水,该过程需要控温的原因是________ 。
(4)减压蒸发装置如图所示。实验开始时,应先打开减压泵,从_____ (填字母)口通入冷水,再打开旋转主机;实验结束时应先关闭旋转主机,再_______ ,打开阀门a通大气后,最后取下______ (填仪器名称),从中获得聚铁。本实验采取减压蒸发的理由是___________ 。

(5)测定聚合硫酸铁样品主要成分的化学式。准确称取所得聚铁样品5.520g,溶于适量稀盐酸中,然后分成两等份:
a.一份加入过量的BaCl2溶液,然后过滤、洗涤、干燥,称重,得固体质量1.165g;
b.另一份置于250mL锥形瓶中,加入过量KI,充分反应后再用0.5000 mol•L-1Na2S2O3溶液滴定至终点,消耗标准溶液20.00mL。
已知:I2+2S2O32–=2I–+S4O62–(无色)
①计算所得产品化学式中n=_______ 。
②若m=4,写出“聚合”过程的化学方程式:______ 。

回答下列问题:
(1)试剂A为
(2)本实验中两次加入硫酸,其中“加热浓缩“时加入稀硫酸,除了抑制离子水解,还为了
(3)“控温氧化”时选用绿色氧化剂双氧水,该过程需要控温的原因是
(4)减压蒸发装置如图所示。实验开始时,应先打开减压泵,从

(5)测定聚合硫酸铁样品主要成分的化学式。准确称取所得聚铁样品5.520g,溶于适量稀盐酸中,然后分成两等份:
a.一份加入过量的BaCl2溶液,然后过滤、洗涤、干燥,称重,得固体质量1.165g;
b.另一份置于250mL锥形瓶中,加入过量KI,充分反应后再用0.5000 mol•L-1Na2S2O3溶液滴定至终点,消耗标准溶液20.00mL。
已知:I2+2S2O32–=2I–+S4O62–(无色)
①计算所得产品化学式中n=
②若m=4,写出“聚合”过程的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:
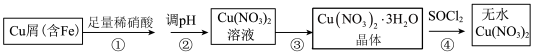
已知:SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(1)写出第②步调 pH适合的一种物质______ (填化学式),调 pH 后需进行的操作是_____ 。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至______ 。
(3)第④步中发生反应的化学方程式是______ 。
(4)第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由_______ 。
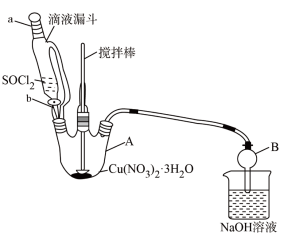
装置改进后,向仪器 A 中缓慢滴加 SOCl2时,需打开活塞_____ (填“a”“b”或“a 和 b”)。
(5)Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2,若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:_______ 。
(6)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:
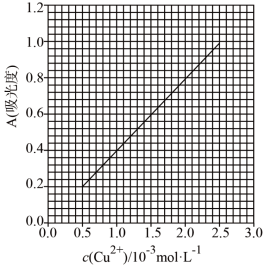
准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_______ (以质量分数表示)。

已知:SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(1)写出第②步调 pH适合的一种物质
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至
(3)第④步中发生反应的化学方程式是
(4)第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由

装置改进后,向仪器 A 中缓慢滴加 SOCl2时,需打开活塞
(5)Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2,若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:
(6)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是
您最近一年使用:0次
3 . 已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__ 。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=__ 。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__ ,溶液中离子浓度大小关系为__ 。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=__ 。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__ 。(已知lg2=0.3)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
2019-12-19更新
|
100次组卷
|
2卷引用:江西省抚州市南城县第二中学2019-2020学年高二上学期第二次月考化学试题
名校
解题方法
4 . 部分弱酸的电离平衡常数如表:
(1)上表的6种酸进行比较,酸性最弱的是:__________ ;HCOO-、S2-、HSO3-3种离子中,最难结合H+的是______________________ 。
(2)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:_______________________ 。
(3)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:_______________________ 。
(4)下列离子方程式书写正确的是
A.HNO2+HS-== NO2-+ H2S↑ B.2HCOOH+SO32-== 2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-== 2HCOOH+SO32- D.H2SO3+SO32-== 2HSO3-
E.H 2C2O4+ NO2-=HC2O4-+HNO2
(5)将少量的SO2通入Na2C2O4溶液,写出离子方程式____________________________ 。
(6)已知HX为一元弱酸。HX的电离常数为5.5×10-8。某混合溶液中含有4molNaX.2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,计算某些物质的量:Na2CO3_____________ ,NaHCO3____________________ 。
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 | H2CO3 |
| 电离平衡常数 (25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
(1)上表的6种酸进行比较,酸性最弱的是:
(2)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:
(3)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:
(4)下列离子方程式书写正确的是
A.HNO2+HS-== NO2-+ H2S↑ B.2HCOOH+SO32-== 2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-== 2HCOOH+SO32- D.H2SO3+SO32-== 2HSO3-
E.H 2C2O4+ NO2-=HC2O4-+HNO2
(5)将少量的SO2通入Na2C2O4溶液,写出离子方程式
(6)已知HX为一元弱酸。HX的电离常数为5.5×10-8。某混合溶液中含有4molNaX.2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,计算某些物质的量:Na2CO3
您最近一年使用:0次
名校
解题方法
5 . 碳、氮及其化合物在生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
CH4(g) + 4NO(g) 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=____ 。
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____ (填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
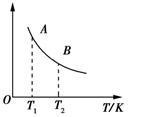
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA___ KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些___________ 。
a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是____ (填字母)。
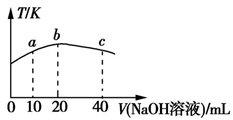
a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g)
 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;CH4(g) + 4NO(g)
 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g)
 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA

a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是

a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
您最近一年使用:0次
名校
解题方法
6 . 研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g) CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g) 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为_________ 。
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
①实验2和实验3相比,其平衡常数关系是K2______ K3(填“>”、“<”或“=”)。
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为________ 。
(3)科学家提出由CO2制取C的太阳能工艺如图1所示。
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则FexOy的化学式为______________ 。
②“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________ 。

(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题(若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-_____________ (填“能”或“不能”)大量共存。
②求H2CO3一级电离平衡常数的数值Ka1=________________ 。
③人体血液里主要通过碳酸氢盐缓冲体系c(H2CO3)/c(HCO3-)可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将_______ 。
A.变大 B.变小 C.基本不变 D.无法判断
(1)已知:①CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1②2H2(g)+CO(g)
 CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1③2H2(g)+O2(g)
 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-125℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol·L-1 | H2O初始浓度/mol·L-1 |
| 1 | 400 | P | 3.0 | 7.0 |
| 2 | T | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为
(3)科学家提出由CO2制取C的太阳能工艺如图1所示。
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则FexOy的化学式为
②“热分解系统”中每分解lmolFexOy,转移电子的物质的量为

(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题(若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-
②求H2CO3一级电离平衡常数的数值Ka1=
③人体血液里主要通过碳酸氢盐缓冲体系c(H2CO3)/c(HCO3-)可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将
A.变大 B.变小 C.基本不变 D.无法判断
您最近一年使用:0次
名校
解题方法
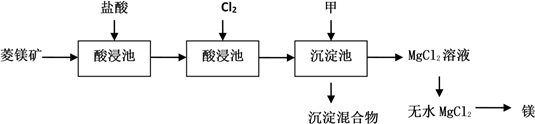
7 . 如图是工业制取菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程
请回答有关问题:
(1)菱镁矿进入酸浸池前需要粉碎,目的是___________ 。
(2)氧化池通入Cl2的目的是氧化___________ (填化学式),工业上不选用硝酸做氧化剂的原因是___________ 和___________ 。
(3)物质甲可以是___________
A、MgO B、Mg(OH)2 C、NaOH溶液 D、稀氨水
(4)由MgCl2溶液制取无水MgCl2的操作方法___________ 。
(5)当Fe3+完全沉淀时,求最小pH___________ 。已知:氢氧化铁ksp=1.0×10-38,离子浓度小于1×10-5 mol/L认为沉淀完全

请回答有关问题:
(1)菱镁矿进入酸浸池前需要粉碎,目的是
(2)氧化池通入Cl2的目的是氧化
(3)物质甲可以是
A、MgO B、Mg(OH)2 C、NaOH溶液 D、稀氨水
(4)由MgCl2溶液制取无水MgCl2的操作方法
(5)当Fe3+完全沉淀时,求最小pH
您最近一年使用:0次
2017-09-01更新
|
373次组卷
|
3卷引用:黑龙江省大庆实验中学2018届高三上学期期初考试化学试题
8 . Ⅰ.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中.

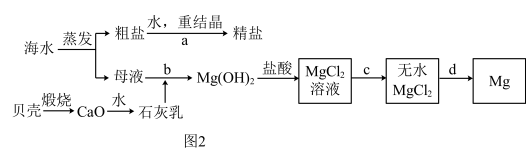
(1)仅K1闭合,石墨棒周围溶液pH升高,其电极反应式为___________________ .
(2)仅K2闭合,在铁棒附近滴加酚酞显红色,理由是______________________ (用平衡移动原理解释).
(3)仅K2闭合,发生总反应的离子方程式为________________________________ .
Ⅱ. 海水的综合利用可以制备金属镁和精盐,其流程如图所示:
(1)步骤a中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是________ .
(2)为使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5mol•L﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在___________ .(常温下,Mg(OH)2的Ksp=1×10﹣11)
(3)步骤c必须在氯化氢气体的氛围中加热蒸发才能完成,试用化学方程式表示在无氯化氢的情况下不能生成无水MgCl2的原理_________________________________ .
(4)完成步骤d的化学方程式____________________________ .


(1)仅K1闭合,石墨棒周围溶液pH升高,其电极反应式为
(2)仅K2闭合,在铁棒附近滴加酚酞显红色,理由是
(3)仅K2闭合,发生总反应的离子方程式为
Ⅱ. 海水的综合利用可以制备金属镁和精盐,其流程如图所示:
(1)步骤a中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是
(2)为使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5mol•L﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在
(3)步骤c必须在氯化氢气体的氛围中加热蒸发才能完成,试用化学方程式表示在无氯化氢的情况下不能生成无水MgCl2的原理
(4)完成步骤d的化学方程式
您最近一年使用:0次
解题方法
9 . 三草酸合铁酸钾是一种重要的光敏材料和有机反应的催化剂,化学式为K3[Fe(C2O4)3]·3H2O,为翠绿色晶体,溶于水,难溶于乙醇。110℃下失去三分子结晶水,230℃时分解。该配合物对光敏感,光照下即发生分解。
Ⅰ、三草酸合铁酸钾的制备
①溶解:在托盘天平上称取4.0gFeSO4·7H2O晶体,放入250mL烧杯中,加入1 mol·L-1 H2SO4 1mL,再加入H2O 15mL,加热使其溶解。
②沉淀:在上述溶液中加入1 mol·L-1 H2C2O4 20mL,搅拌并加热煮沸,使形成FeC2O4·2H2O黄色沉淀,用倾斜法倒出清液,洗涤该沉淀3次以除去可溶性杂质。
③氧化:在上述沉淀中加入10 mL饱和K2C2O4溶液,水浴加热至40℃,滴加3%H2O2溶液20mL,不断搅拌溶液并维持温度在40℃左右,使Fe2+充分氧化为Fe3+。滴加完后,加热溶液至沸腾以除去过量的H2O2。
④生成配合物:保持上述沉淀近沸状态,趁热滴加1 mol·L-11H2C2O4使沉淀溶解至呈现翠绿色为止。冷却后,加入15mL 95%的乙醇水溶液,在暗处放置,结晶。减压过滤,抽干后用少量乙醇洗涤产品,继续抽干,称量,计算产率,并将晶体放在干燥器内避光保存。
Ⅱ、产物中C2O42-的质量分数的测定
称取0.20g产品于锥形瓶中微热溶解并加入2 mL稀硫酸,趁热用0.0200 mol·L-1 KMnO4标准溶液滴定至终点,重复操作2-3次,平均消耗KMnO4溶液的体积为25.00mL。计算产物中C2O42-的质量分数。 请回答下列问题:
(1)步骤①溶解时应加入少量的稀硫酸,目的是__________________________ ;
(2)步骤③用过氧化氢作氧化剂而不选择KMnO4的理由是_______________________ ;
(3)生成的FeC2O4·2H2O晶体上易沾附硫酸盐,如何证明晶体已洗涤干净______________ ;
(4)步骤③需保持恒温40℃,原因是__________________________ ;
(5)用乙醇洗涤的作用是______________________________________________________ ;
(6)滴定终点的现象是_____________________________________ ,通过计算,产物中C2O42-的质量分数为____________________ 。
Ⅰ、三草酸合铁酸钾的制备
①溶解:在托盘天平上称取4.0gFeSO4·7H2O晶体,放入250mL烧杯中,加入1 mol·L-1 H2SO4 1mL,再加入H2O 15mL,加热使其溶解。
②沉淀:在上述溶液中加入1 mol·L-1 H2C2O4 20mL,搅拌并加热煮沸,使形成FeC2O4·2H2O黄色沉淀,用倾斜法倒出清液,洗涤该沉淀3次以除去可溶性杂质。
③氧化:在上述沉淀中加入10 mL饱和K2C2O4溶液,水浴加热至40℃,滴加3%H2O2溶液20mL,不断搅拌溶液并维持温度在40℃左右,使Fe2+充分氧化为Fe3+。滴加完后,加热溶液至沸腾以除去过量的H2O2。
④生成配合物:保持上述沉淀近沸状态,趁热滴加1 mol·L-11H2C2O4使沉淀溶解至呈现翠绿色为止。冷却后,加入15mL 95%的乙醇水溶液,在暗处放置,结晶。减压过滤,抽干后用少量乙醇洗涤产品,继续抽干,称量,计算产率,并将晶体放在干燥器内避光保存。
Ⅱ、产物中C2O42-的质量分数的测定
称取0.20g产品于锥形瓶中微热溶解并加入2 mL稀硫酸,趁热用0.0200 mol·L-1 KMnO4标准溶液滴定至终点,重复操作2-3次,平均消耗KMnO4溶液的体积为25.00mL。计算产物中C2O42-的质量分数。 请回答下列问题:
(1)步骤①溶解时应加入少量的稀硫酸,目的是
(2)步骤③用过氧化氢作氧化剂而不选择KMnO4的理由是
(3)生成的FeC2O4·2H2O晶体上易沾附硫酸盐,如何证明晶体已洗涤干净
(4)步骤③需保持恒温40℃,原因是
(5)用乙醇洗涤的作用是
(6)滴定终点的现象是
您最近一年使用:0次
名校
解题方法
10 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。
2H++SnO22- Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-
请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______ 。
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是_______ ;此锡粉样品中锡的质量分数________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:
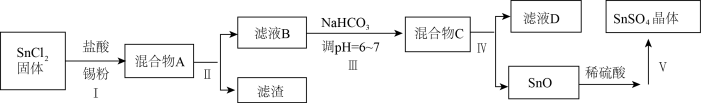
① 步骤I加入Sn粉的作用:___________ 及调节溶液pH。
② 步骤Ⅲ生成SnO的离子方程式:____________________ 。
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是____________ ,镀锡铁破损后在潮湿的环境中容易发生腐蚀的原因是_________ ,若是在较弱的酸性环境中发生腐蚀,正极反应式是____________ 。
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为___________ 。
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是________ ;
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用________ 。
2H++SnO22-
 Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:

① 步骤I加入Sn粉的作用:
② 步骤Ⅲ生成SnO的离子方程式:
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用
您最近一年使用:0次
2017-05-15更新
|
706次组卷
|
2卷引用:2017年高考信息卷(二)(全国卷I)理科综合化学试题



