名校
解题方法
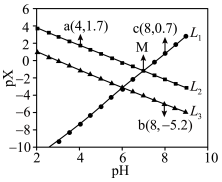
1 . 常温下,在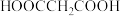 (简记为
(简记为 )和
)和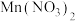 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、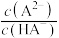 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
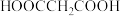 (简记为
(简记为 )和
)和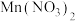 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、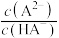 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
A. 代表 代表 与 与 的关系 的关系 |
B.直线 和 和 的交叉点坐标为 的交叉点坐标为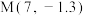 |
C.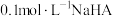 溶液中: 溶液中: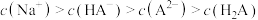 |
D.常温下,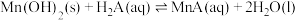 的 的 值为 值为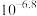 |
您最近一年使用:0次
2024-04-05更新
|
195次组卷
|
2卷引用:吉林省白山市2023-2024学年高三第二次模拟考试化学试题
名校
解题方法
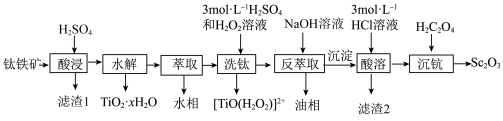
2 . 氧化钪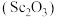 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为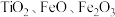 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至 时可认为沉淀完全。
时可认为沉淀完全。
②室温下 完全沉淀的
完全沉淀的 为1.05。
为1.05。
③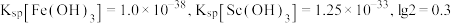 。
。
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是_______ 。
(2) 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式_______ 。
(3)萃取剂萃取 的反应原理为阳离子交换:
的反应原理为阳离子交换: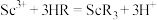 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是_______ 。
(4)“酸溶”后滤液中存在的金属阳离子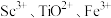 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是_______ 。
(5)由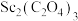 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式_______ 。
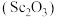 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为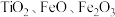 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至
 时可认为沉淀完全。
时可认为沉淀完全。②室温下
 完全沉淀的
完全沉淀的 为1.05。
为1.05。③
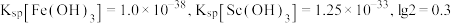 。
。回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是(2)
 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式(3)萃取剂萃取
 的反应原理为阳离子交换:
的反应原理为阳离子交换: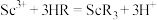 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是(4)“酸溶”后滤液中存在的金属阳离子
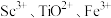 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是(5)由
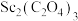 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式
您最近一年使用:0次
2023-12-19更新
|
300次组卷
|
2卷引用:湖南省雅礼教育集团2023-2024学年高二上学期期中考试化学试题
名校
解题方法
3 . 利用转炉烟尘(主要成分:CuO、ZnO、PbO、Sb4O6、As2O5)制备硫酸铜联产硫酸锌以及聚合硫酸铁的工艺流程如图:

已知:①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中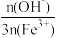 ×100%]越大,絮凝效果越好。
×100%]越大,絮凝效果越好。
回答下列问题:
(1)“酸浸渣”中所含金属化合物是______ (填化学式)。常温下,调节“酸浸液”pH为______ (保留小数点后一位)时,溶液中c(Cu2+)=0.01mol•L-1。
(2)生成Ca3(AsO4)2•Ca(OH)2的化学方程式为________ 。
(3)在一定温度下,将NaClO4加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。
①x和y的关系应满足:y=______ (用含x的式子表示)。
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是________ 。

(4)①“萃余液”经______ 、______ 、过滤、洗涤,得到ZnSO4•7H2O晶体。
②加热ZnSO4•7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4•7H2O(M=287g•mol-1)加热到145℃时得到ZnSO4•xH2O,其中x的值为______ ;温度为1050℃时,ZnSO4固体完全分解为ZnO以及两种气体(只有一种是氧化物),该反应的化学方程式为_______ 。


已知:①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中
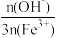 ×100%]越大,絮凝效果越好。
×100%]越大,絮凝效果越好。回答下列问题:
(1)“酸浸渣”中所含金属化合物是
(2)生成Ca3(AsO4)2•Ca(OH)2的化学方程式为
(3)在一定温度下,将NaClO4加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。
①x和y的关系应满足:y=
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是

(4)①“萃余液”经
②加热ZnSO4•7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4•7H2O(M=287g•mol-1)加热到145℃时得到ZnSO4•xH2O,其中x的值为

您最近一年使用:0次
名校
4 . 已知部分弱酸的电离平衡常数如表,根据表中数据回答下列问题。
(1)已知某浓度的 水溶液
水溶液 ,原因是
,原因是_______ (用离子方程式表示), 的
的 溶液中,由水电离出的
溶液中,由水电离出的 浓度为
浓度为_______ 。
(2)同浓度 这4种溶液中碱性由强到弱的顺序是
这4种溶液中碱性由强到弱的顺序是_______ ; 溶液中各离子浓度由大到小的顺序是
溶液中各离子浓度由大到小的顺序是_______ 。
(3)体积相同、 相同的三种酸溶液a.
相同的三种酸溶液a. ;b.
;b. ;c.
;c. 分别与同浓度的
分别与同浓度的 溶液完全中和,消耗
溶液完全中和,消耗 溶液的体积由大到小的排列顺序是(填字母)
溶液的体积由大到小的排列顺序是(填字母)_______ 。
| 弱酸 |  |  |  |
电离平衡常 | 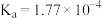 |  | 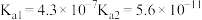 |
 水溶液
水溶液 ,原因是
,原因是 的
的 溶液中,由水电离出的
溶液中,由水电离出的 浓度为
浓度为(2)同浓度
 这4种溶液中碱性由强到弱的顺序是
这4种溶液中碱性由强到弱的顺序是 溶液中各离子浓度由大到小的顺序是
溶液中各离子浓度由大到小的顺序是(3)体积相同、
 相同的三种酸溶液a.
相同的三种酸溶液a. ;b.
;b. ;c.
;c. 分别与同浓度的
分别与同浓度的 溶液完全中和,消耗
溶液完全中和,消耗 溶液的体积由大到小的排列顺序是(填字母)
溶液的体积由大到小的排列顺序是(填字母)
您最近一年使用:0次
2022-04-04更新
|
78次组卷
|
2卷引用:新疆乌鲁木齐市第四中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
5 . 实验室以碳酸锰矿(含MnCO3及少量Fe、Al、Si等氧化物)为原料制高纯MnCO3和MnO2的流程如下:

(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:______ 。
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4) ,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4)
,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4) 与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量
与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量___________ (写出计算过程)。
(3)将过滤后所得溶液净化后可得MnSO4溶液。
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。
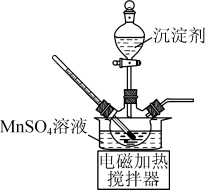
a.不使用Na2CO3溶液的原因是___________ 。
b.不使用NH4HCO3溶液的原因是___________ 。
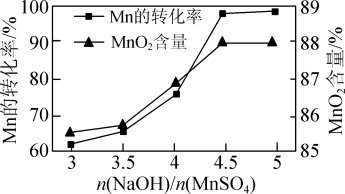
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{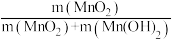 }与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
}与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,___________ ,得到纯净的MnO2(实验中可使用的试剂是1.0mol·L-1 NaOH溶液、1.0mol·L-1 H2SO4溶液、1.0mol·L-1 BaCl2溶液)。

(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4)
 ,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4)
,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4) 与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量
与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量(3)将过滤后所得溶液净化后可得MnSO4溶液。
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。

a.不使用Na2CO3溶液的原因是
b.不使用NH4HCO3溶液的原因是
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{
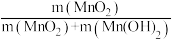 }与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
}与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
您最近一年使用:0次
2022-03-29更新
|
817次组卷
|
4卷引用:江苏省2022届高三下学期3月第一次调研测试化学试题
江苏省2022届高三下学期3月第一次调研测试化学试题(已下线)化学-2022年高考押题预测卷03(福建卷)江苏省苏州市重点中学2022-2023学年高三上学期10月月考化学试题江苏省南京市中华中学2022-2023学年高三上学期期末考试化学试题
解题方法
6 . 氯化铜广泛地用作有机合成催化剂。实验室模拟工业以粗铜粉(含杂质Fe)为原料,制备氯化铜。某小组设计的实验方案如下:
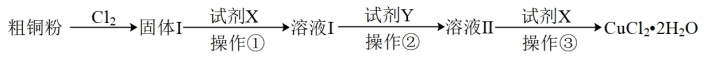
已知:
i.粗铜粉与气体完全反应。
ii.部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为 计算)。
计算)。
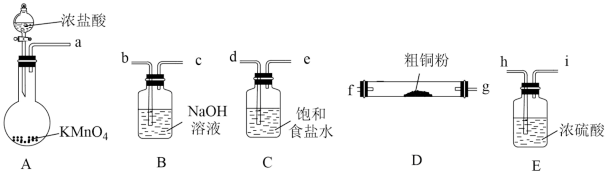
(1)现用如图所示的实验仪器和药品制备纯净、干燥的 并与粗铜粉反应(夹持及加热装置已省略)。按气流从左到右的方向连接各仪器接口,正确的顺序是a→
并与粗铜粉反应(夹持及加热装置已省略)。按气流从左到右的方向连接各仪器接口,正确的顺序是a→___________ (填小写字母)。。
(2)上述方案中,试剂X的名称是___________ ;试剂Y的作用是___________ (用离子方程式表示);操作③是___________ 。
(3)在溶液Ⅱ转化为 的操作过程中,发现溶液颜色由蓝色变为绿色。同学欲探究其原因,查文献知:
的操作过程中,发现溶液颜色由蓝色变为绿色。同学欲探究其原因,查文献知: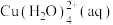 (蓝色)
(蓝色) (绿色)
(绿色)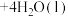 。
。
设计简单实验,证明溶液中有上述转化关系___________ 。
(4)为测定产品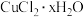 中结晶水的数目x,可采取如下实验步骤:
中结晶水的数目x,可采取如下实验步骤:
a.用托盘天平称取一定质量氯化铜晶体。
b.在坩埚中充分灼烧。
c.在___________ (填仪器名称)中冷却。
d.称量所得黑色固体质量。
e.重复b~d操作直至___________ 。
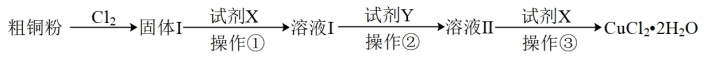
已知:
i.粗铜粉与气体完全反应。
ii.部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为
 计算)。
计算)。| 离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 1.1 | 3.2 |
 | 4.4 | 6.4 |
 并与粗铜粉反应(夹持及加热装置已省略)。按气流从左到右的方向连接各仪器接口,正确的顺序是a→
并与粗铜粉反应(夹持及加热装置已省略)。按气流从左到右的方向连接各仪器接口,正确的顺序是a→
(2)上述方案中,试剂X的名称是
(3)在溶液Ⅱ转化为
 的操作过程中,发现溶液颜色由蓝色变为绿色。同学欲探究其原因,查文献知:
的操作过程中,发现溶液颜色由蓝色变为绿色。同学欲探究其原因,查文献知: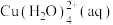 (蓝色)
(蓝色) (绿色)
(绿色)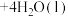 。
。设计简单实验,证明溶液中有上述转化关系
(4)为测定产品
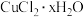 中结晶水的数目x,可采取如下实验步骤:
中结晶水的数目x,可采取如下实验步骤:a.用托盘天平称取一定质量氯化铜晶体。
b.在坩埚中充分灼烧。
c.在
d.称量所得黑色固体质量。
e.重复b~d操作直至
您最近一年使用:0次
解题方法
7 . 二水合磷酸二氢锰具有广泛用途,被用作防锈剂。某化工拟用软锰矿(含MnO2及少量FeO、Al2O3和SiO2)为原料生产Mn(H2PO4)2·2H2O,其工艺流程如下所示,请回答下列问题:
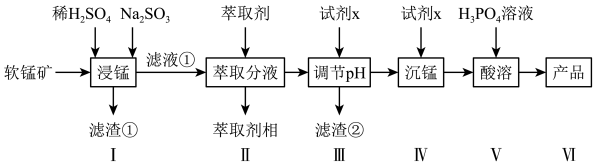
(1)Mn元素位于元素周期表第___________ 周期第___________ 族。
(2)滤渣①的主要成分是___________ 。
(3)适量Na2SO3固体作为还原剂,将MnO2还原为Mn2+,该反应的离子方程式为_____ 。
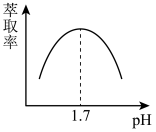
(4)检验滤液①中是否含有Fe2+,可以用___________溶液。
(5)步骤II是用萃取剂萃取溶液中的Fe3+, Fe3+的萃取率与pH的关系如下图,当溶液pH>1.7,随pH增大Fe3+萃取率下降的原因是___________ 。
(6)已知该条件下在步骤III中Ksp[Al(OH) 3] = 10 ×10-33, Ksp[Mn(OH)2]= 1.0 ×10-14.试剂x为Na2CO3,若c(Mn2+)=1.0 mol·L-1,调节pH范围应为4.7≤pH___________ 。
(7)步骤V酸溶时可能产生磷酸锰和磷酸氢锰杂质,因此加入H3PO4至溶液呈酸性才能保证生成物质较多为Mn(H2PO4)2,用离子方程式说明原因___________ 。已知磷酸锰难溶于水,磷酸氢锰和磷酸二氢锰易溶与水。

(1)Mn元素位于元素周期表第
(2)滤渣①的主要成分是
(3)适量Na2SO3固体作为还原剂,将MnO2还原为Mn2+,该反应的离子方程式为
(4)检验滤液①中是否含有Fe2+,可以用___________溶液。
| A.KSCN | B.KFe[Fe(CN)6] |
| C.K3[Fe(CN)6] | D.Fe3[Fe(CN)6]2 |

(6)已知该条件下在步骤III中Ksp[Al(OH) 3] = 10 ×10-33, Ksp[Mn(OH)2]= 1.0 ×10-14.试剂x为Na2CO3,若c(Mn2+)=1.0 mol·L-1,调节pH范围应为4.7≤pH
(7)步骤V酸溶时可能产生磷酸锰和磷酸氢锰杂质,因此加入H3PO4至溶液呈酸性才能保证生成物质较多为Mn(H2PO4)2,用离子方程式说明原因
您最近一年使用:0次
解题方法
8 . 室温下,通过下列实验探究 溶液的性质。
溶液的性质。
下列有关说法正确的是
 溶液的性质。
溶液的性质。| 选项 | 实验操作和现象 |
| 1 | 向0.1  溶液中滴加酸性高锰酸钾溶液,溶液紫红色褪去 溶液中滴加酸性高锰酸钾溶液,溶液紫红色褪去 |
| 2 | 用pH试纸测定0.1  溶液的pH,测得pH约为8 溶液的pH,测得pH约为8 |
| 3 | 向0.1  溶液中加入过量0.2 溶液中加入过量0.2  溶液,产生白色沉淀 溶液,产生白色沉淀 |
| 4 | 向0.1  溶液中滴加等体积的0.1 溶液中滴加等体积的0.1 HCl溶液,测得pH约为5.5 HCl溶液,测得pH约为5.5 |
A.实验1说明 具有漂白性 具有漂白性 |
B.0.1  溶液中存在 溶液中存在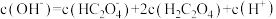 |
C.实验3反应静置后的上层清液中有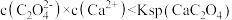 |
D.实验4得到的溶液中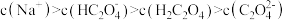 |
您最近一年使用:0次
解题方法
9 . 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105°C ,沸点79 °C,140°C 以上时易分解。遇水剧烈反应生成SO2和HCl两种气体,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。
(1)实验室合成SOCl2的原理之一为SO2 +Cl2 + SCl2 2SOCl2,部分装置(夹持、加热装置略去)如图所示。
2SOCl2,部分装置(夹持、加热装置略去)如图所示。
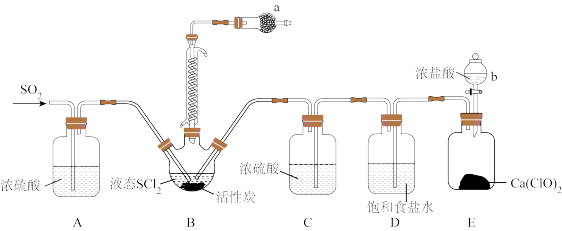
①实验室用亚硫酸钠固体与70%硫酸制备SO2,不用稀硫酸的原因为_______ 。
②装置A、C除干燥气体外,另一作用是_______ ;装置D的作用为_______ 。
③仪器b的名称为_______ ;写出装置 E中发生反应的化学方程式:_______ 。
④仪器a中的试剂为_______ 。
(2)甲同学设计实验利用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3。
①用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3时,SOCl2的作用为_______ 。
②实验室常用过量NaOH溶液吸收SOCl2,写出反应的离子方程式:_______ 。
(1)实验室合成SOCl2的原理之一为SO2 +Cl2 + SCl2
 2SOCl2,部分装置(夹持、加热装置略去)如图所示。
2SOCl2,部分装置(夹持、加热装置略去)如图所示。
①实验室用亚硫酸钠固体与70%硫酸制备SO2,不用稀硫酸的原因为
②装置A、C除干燥气体外,另一作用是
③仪器b的名称为
④仪器a中的试剂为
(2)甲同学设计实验利用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3。
①用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3时,SOCl2的作用为
②实验室常用过量NaOH溶液吸收SOCl2,写出反应的离子方程式:
您最近一年使用:0次
10 . 常温下,向1L0.1mol·L-1—酸HR溶液中缓慢通氨气[已知常温下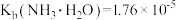 ],假设溶液温度和体积保持不变,混合溶液的pH与
],假设溶液温度和体积保持不变,混合溶液的pH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
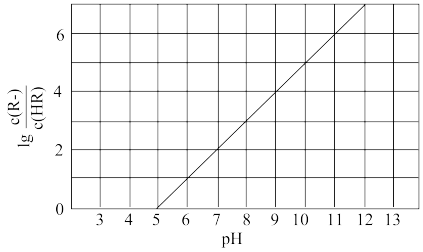
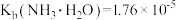 ],假设溶液温度和体积保持不变,混合溶液的pH与
],假设溶液温度和体积保持不变,混合溶液的pH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
A. 的HR溶液的pH约为3 的HR溶液的pH约为3 |
B.HR为弱酸,常温时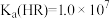 |
C.当通入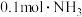 时,溶液中 时,溶液中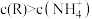 |
D.当溶液呈中性时,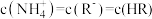 |
您最近一年使用:0次



