解题方法
1 . 已知25℃时,AgCl的溶度积Ksp=1.8×10-10mol2·L-2,则下列说法正确的是
| A.向饱和AgCl水溶液中加入盐酸,Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl沉淀析出 |
| D.在AgCl的悬浊液中加入Na2S溶液,AgCl转化为Ag2S,因为AgCl溶解度大于Ag2S |
您最近一年使用:0次
解题方法
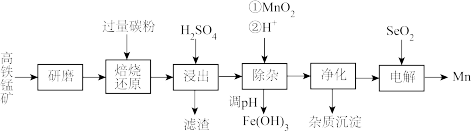
2 . 在钢铁工业中,主要用锰脱硫和脱氧:锰也是作为合金的添加料。一种以高铁锰矿(含 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下, 的
的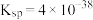 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于 认为该离子沉淀完全。
认为该离子沉淀完全。
回答下列问题:
(1)研磨的目的是_______ 。
(2)“焙烧还原”时,原料中高铁锰矿中 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为_______ 、_______ 。(填化学式)
(3)下表数据是焙烧后 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为_______  。
。
(4)“浸出”产生两种“滤渣”的成分为_______ 、_______ (填化学式):该步骤中,工业上往往需再加入少量固体 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因_______ 。
(5)常温下,“除杂”时 参加的反应的离子方程式为
参加的反应的离子方程式为_______ ;再逐步调
_______ 至 完全沉淀。
完全沉淀。
(6)研究表明,加入适量的 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为_______ 。
 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下,
 的
的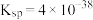 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于 认为该离子沉淀完全。
认为该离子沉淀完全。回答下列问题:
(1)研磨的目的是
(2)“焙烧还原”时,原料中高铁锰矿中
 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为(3)下表数据是焙烧后
 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为 。
。还原温度/ | 焙烧后 元素在主要含锰物质中的分布/% 元素在主要含锰物质中的分布/% | ||
 | 高价锰( ) ) | 低价锰( ) ) | |
| 600 800 1000 1100 1200 | 40.92 10.56 6.01 痕量 痕量 | 34.76 6.63 2.70 0.46 0.30 | 24.32 82.81 91.29 98.76 97.94 |
 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因(5)常温下,“除杂”时
 参加的反应的离子方程式为
参加的反应的离子方程式为
 完全沉淀。
完全沉淀。(6)研究表明,加入适量的
 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为
您最近一年使用:0次
名校
解题方法
3 . I.某酸H2A在水中的电离方程式是:H2A=H++HA-,HA-⇌H++A2-。回答下列问题:
(1)Na2A溶液显______ (填“酸性”“中性”或“碱性”),用离子方程式表示其原因________ 。
(2)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是_______。
II.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下;
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37℃时,Ka=4.0×10-6)
②NaUr(s)⇌Ur-(aq)+Na+(aq)
(3)37℃时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________ 。
(4)关节炎发作多在脚趾和手指的关节处,当天气变冷时,关节炎变得严重,这说明温度降低时,尿酸钠的Ksp________ (填“增大”“减小”或“不变”),生成尿酸钠晶体的反应是_____ (填“放热”或“吸热”)反应。
(5)37℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L-1,其中尿酸分子的浓度为5.0×10-4mol·L-1,该病人尿液的c(H+)为_______ ,pH______ 7(填“>”“=”或“<”)。
(1)Na2A溶液显
(2)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是_______。
| A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 | B.c(OH-)=c(H+)+c(HA-)+2c(H2A) |
| C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) | D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
II.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下;
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37℃时,Ka=4.0×10-6)
②NaUr(s)⇌Ur-(aq)+Na+(aq)
(3)37℃时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为
(4)关节炎发作多在脚趾和手指的关节处,当天气变冷时,关节炎变得严重,这说明温度降低时,尿酸钠的Ksp
(5)37℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L-1,其中尿酸分子的浓度为5.0×10-4mol·L-1,该病人尿液的c(H+)为
您最近一年使用:0次
名校
解题方法
4 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。
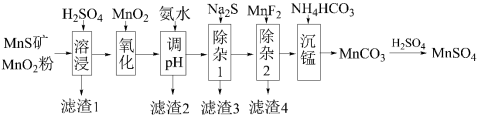
已知:①“滤渣1”含有S和 ;
;
②相关金属离子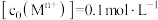 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“氧化”中添加适量的 的作用是
的作用是________ 。
(2)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为________ ~6之间。
(3)“除杂1”的目的是除去 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是________ 。
(4)“除杂2”的目的是生成 时沉淀除去
时沉淀除去 。该步骤维持溶液pH恒为4.0,若1 L溶液中
。该步骤维持溶液pH恒为4.0,若1 L溶液中 的初始浓度为0.1 mol/L,现欲将
的初始浓度为0.1 mol/L,现欲将 沉淀完全(即剩余离子浓度小于
沉淀完全(即剩余离子浓度小于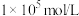 时),则需要加入的
时),则需要加入的 固体至少达到
固体至少达到________ mol( 为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高,
为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是________ 。(已知: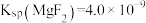 ;
; )
)
(5)写出“沉猛”的离子方程式:________ 。
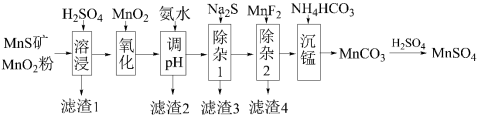
已知:①“滤渣1”含有S和
 ;
;②相关金属离子
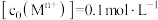 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“氧化”中添加适量的
 的作用是
的作用是(2)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为
(3)“除杂1”的目的是除去
 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是(4)“除杂2”的目的是生成
 时沉淀除去
时沉淀除去 。该步骤维持溶液pH恒为4.0,若1 L溶液中
。该步骤维持溶液pH恒为4.0,若1 L溶液中 的初始浓度为0.1 mol/L,现欲将
的初始浓度为0.1 mol/L,现欲将 沉淀完全(即剩余离子浓度小于
沉淀完全(即剩余离子浓度小于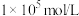 时),则需要加入的
时),则需要加入的 固体至少达到
固体至少达到 为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高,
为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是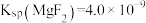 ;
; )
)(5)写出“沉猛”的离子方程式:
您最近一年使用:0次
2022-03-08更新
|
184次组卷
|
2卷引用:河南省范县第一中学等学校2021-2022学年高二上学期联考检测化学试题
名校
解题方法
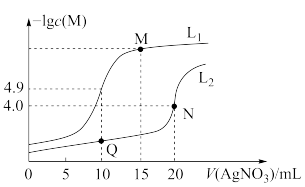
5 . 某温度下,分别向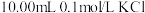 和
和 溶液中滴加
溶液中滴加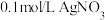 溶液,滴加过程中
溶液,滴加过程中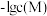 (M为
(M为 或
或 )与
)与 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法不正确 的是
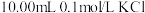 和
和 溶液中滴加
溶液中滴加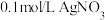 溶液,滴加过程中
溶液,滴加过程中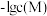 (M为
(M为 或
或 )与
)与 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法
A.曲线 表示 表示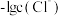 与 与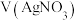 的变化关系 的变化关系 |
B.M点溶液中: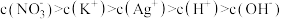 |
C.该温度下,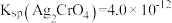 |
D.相同实验条件下,若改为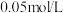 的 的 和 和 溶液,则曲线 溶液,则曲线 中N点移到Q点 中N点移到Q点 |
您最近一年使用:0次
2022-01-11更新
|
1340次组卷
|
19卷引用:湖南省邵阳市2021-2022学年高三上学期第一次联考化学试题
湖南省邵阳市2021-2022学年高三上学期第一次联考化学试题2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】福建省厦门市2020届高三毕业班五月质量检查理综化学试题福建省厦门市2020届高三高考化学模拟(5月份)理综化学试题(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编河北省石家庄市2019届高三毕业班模拟考试(一)化学试题福建省福州第三中学2021-2022学年高三上学期第六次质量检测化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)广东省广州市第六中学2022届高三第三次模拟考试化学试题(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)化学(湖南A卷)-学易金卷:2023年高考化学第一次模拟考试卷(已下线)化学(湖北A卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)化学(山东B卷)-学易金卷:2023年高考第一次模拟考试卷湖南省长沙市明达中学2022-2023学年高三下学期2月月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第53讲 沉淀溶解平衡图像的分析(已下线)2022年福建省高考真题变式题(选择题6-10)湖南省岳阳市第一中学2023届高三下学期第七次月考化学试题(已下线)第5讲 难溶电解质的溶解平衡陕西省西安交通大学附属中学2023-2024年高二上学期第一次月考化学试题
解题方法
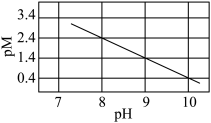
6 . 常温下,向 悬浊液中通入
悬浊液中通入 ,溶液中
,溶液中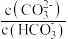 的负对数pM与pH的关系如下。已知
的负对数pM与pH的关系如下。已知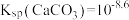 。下列说法错误的是
。下列说法错误的是
 悬浊液中通入
悬浊液中通入 ,溶液中
,溶液中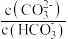 的负对数pM与pH的关系如下。已知
的负对数pM与pH的关系如下。已知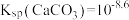 。下列说法错误的是
。下列说法错误的是
A.当溶液中 时,溶液为碱性 时,溶液为碱性 |
B. 悬浊液中 悬浊液中 的浓度大于 的浓度大于 |
C.当浊液中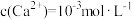 时,其 时,其 |
D. 溶液中的阴离子浓度: 溶液中的阴离子浓度: |
您最近一年使用:0次
解题方法
7 . 室温下,向10mL浓度均为0.1mol/L的CuCl2、FeCl2和ZnCl2溶液中分别滴加等浓度的Na2S溶液,滴加过程中pc[pc=-lgc(M2+),M2+为Cu2+或Fe2+或Zn2+]与Na2S溶液体积的关系如图所示。已知:Ksp(CuS)<Ksp(ZnS),Ksp(FeS)=6.25×10-18,lg25=1.4。下列说法正确的是

| A.m=8.6 |
| B.a点的CuCl2溶液中:2c(Cu2+)>c(Cl−)+c(OH−) |
| C.a→d→g的过程中,水的电离程度经历由大到小后又增大的过程 |
| D.将足量晶体ZnCl2加入0.1mol/L的Na2S溶液中,c(Zn2+)最大可达到10−24.4mol·L−1 |
您最近一年使用:0次
名校
解题方法
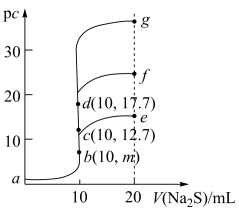
8 . 25℃时,lgS(CaF2)随pH变化如图所示,下列说法错误的是
已知:S(CaF2)(单位:mol·L−1)表示CaF2的溶解度。

已知:S(CaF2)(单位:mol·L−1)表示CaF2的溶解度。
| A.CaF2饱和溶液中2c(Ca2+)=c(F-)+c(HF) |
| B.已知Ksp(CaF2)=4×10-11.1,则水中S(CaF2)=10-3.7mol·L-1 |
| C.pH变化时,CaF2溶液中始终存在:c(F-)>c(Ca2+) |
| D.当pH<7时,2c(Ca2+)+c(H+)>c(F-)+c(OH-) |
您最近一年使用:0次
2021-12-25更新
|
764次组卷
|
12卷引用:广东省深圳大学附属中学2022届高三9月调研考试化学试题
广东省深圳大学附属中学2022届高三9月调研考试化学试题福建省南平市2022届高三10月联考化学试卷甘肃省白银市靖远县第四中学2022届高三10月月考化学试题河北省河北衡水中学2021届高三下学期第一次调研考试化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)备战2022年高考化学精准检测卷【全国卷】08山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题河北省邯郸市永年区第二中学2021-2022学年高二12月月考化学试题甘肃省高台县第一中学2021-2022学年高三上学期期中考试化学(理)试题(已下线)一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题安徽省宿州市萧县鹏程中学2021-2022学年高二下学期第一次质量检测化学试题
2021·全国·模拟预测
名校
解题方法
9 . T℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示,已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数,下列说法正确的是
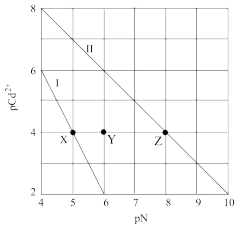

A.X点:c(Cd2+)<c(OH-);Z点:c(CO )<c(Cd2+) )<c(Cd2+) |
| B.溶度积的负对数:pKsp(CdCO3)<pKsp[Cd(OH)2] |
| C.Y点对应的CdCO3溶液为不饱和溶液,可以继续溶解CdCO3 |
D.T℃时,Cd(OH)2(s)+ (aq)⇌CdCO3(s)+2OH-(aq)的平衡常数K为102 (aq)⇌CdCO3(s)+2OH-(aq)的平衡常数K为102 |
您最近一年使用:0次
2021-12-17更新
|
1366次组卷
|
6卷引用:第16周 周测卷-备战2022年高考化学周测与晚练(新高考专用)
(已下线)第16周 周测卷-备战2022年高考化学周测与晚练(新高考专用)河南省商城县观庙高级中学2021-2022学年高二上学期12月月考化学试题福建省福州高级中学2021-2022学年高二上学期期末化学考试题(已下线)【直击双一流】02-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)押江苏卷第13题 水溶液中的离子平衡 -备战2022年高考化学临考题号押题(江苏卷)湖南省株洲市攸县第一中学2022届高三下学期四月月考化学试题
名校
10 . 用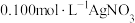 滴定
滴定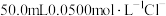 溶液的滴定曲线如图所示。下列有关描述错误的是
溶液的滴定曲线如图所示。下列有关描述错误的是
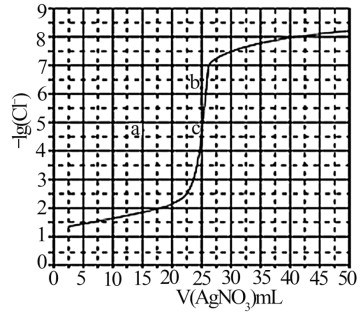
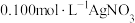 滴定
滴定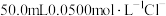 溶液的滴定曲线如图所示。下列有关描述错误的是
溶液的滴定曲线如图所示。下列有关描述错误的是
A.相同实验条件下,若改为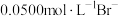 ,反应终点c向b方向移动 ,反应终点c向b方向移动 |
B.曲线上各点的溶液满足关系式 |
C.根据曲线数据计算可知的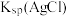 数量级为 数量级为 |
D.相同实验条件下,若改为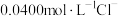 ,反应终点c移到a ,反应终点c移到a |
您最近一年使用:0次



