名校
解题方法
1 . 下列实验操作能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 | 测定NaClO溶液的pH |
| B | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 取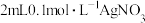 溶液,先后滴加3滴 溶液,先后滴加3滴 溶液和5滴 溶液和5滴 溶液,观察沉淀情况 溶液,观察沉淀情况 | 比较 、 、 的大小 的大小 |
| D | 将 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 | 检验 样品是否变质 样品是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-08-01更新
|
801次组卷
|
7卷引用:江西省赣州市赣县第三中学2021-2022学年高二上学期12月月考化学试卷
江西省赣州市赣县第三中学2021-2022学年高二上学期12月月考化学试卷选择性必修1(SJ)专题3专题综合检测(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)安徽省六安市第一中学2021-2022学年高二下学期开学考试化学试题河南省中原名校2021-2022学年高二上学期期末联考化学试题(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)河南省南阳市第八中学校2022-2023学年高二上学期线上期末考试化学试题
名校
2 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 将FeCl3饱和溶液滴加到NaOH溶液中 | 制得Fe(OH)3胶体 |
| B | 室温下,向1mL0.1mol·L-1AgNO3溶液中加入几滴0.1mol·L-1NaCl溶液出现白色沉淀,再滴加几滴0.1mol·L-1NaI溶液,出现黄色沉淀 | 证明相同温度下:Ksp(AgCl)>Ksp(AgI) |
| C | 常温下,测得相同浓度溶液的pH:NaA>NaB | 证明常温下的水解程度:A-<B- |
| D | 等体积pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HA是弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-31更新
|
255次组卷
|
5卷引用:江西省赣州市2020-2021学年高二上学期期末考试化学试题
3 . 钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s) Sr2+(aq)+SO
Sr2+(aq)+SO (aq)Ksp=2.5×10-7
(aq)Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+CO
Sr2+(aq)+CO (aq)Ksp=2.5×10-9
(aq)Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为__ ;该反应的平衡常数表达式为__ 。
(2)对于上述反应,实验证明增大CO 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
①升高温度,平衡常数K将__ 。
②增大CO 的浓度,平衡常数K将
的浓度,平衡常数K将__ 。
已知:SrSO4(s)
 Sr2+(aq)+SO
Sr2+(aq)+SO (aq)Ksp=2.5×10-7
(aq)Ksp=2.5×10-7SrCO3(s)
 Sr2+(aq)+CO
Sr2+(aq)+CO (aq)Ksp=2.5×10-9
(aq)Ksp=2.5×10-9(1)将SrSO4转化成SrCO3的离子方程式为
(2)对于上述反应,实验证明增大CO
 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。①升高温度,平衡常数K将
②增大CO
 的浓度,平衡常数K将
的浓度,平衡常数K将
您最近一年使用:0次
名校
解题方法
4 . 下列实验方案能实现相应实验目的或得出相应结论的是
| 选项 | 实验方案 | 实验目的或结论 |
| A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,未出现银镜 | 蔗糖未水解 |
| B | 将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入溴水中,褪色 | 证明溴乙烷的消去反应有乙烯生成 |
| C | 用两支试管各取5mL0.1mol·L-1的KMnO4溶液,分别加入2mL0.1mol·L-1和0.2mol·L-1的草酸溶液,记录溶液褪色所需的时间 | 探究浓度对化学反应速率的影响 |
| D | 在相同温度下,向1mL0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol·L-1FeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-04-08更新
|
321次组卷
|
2卷引用:江西省宜春市第一中学2022-2023学年高二下学期期末考试化学试题
名校
解题方法
5 . 下列实验操作能达到实验目的的是
| 目的 | 操作 | |
| A | 测定NaClO溶液的pH | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比 |
| B | 验证Ksp(AgCl)>Ksp( AgI) | 取2 mL0. 1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀 |
| C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
| D | 检验Fe(NO3)2晶体是否已 氧化变质 | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-24更新
|
624次组卷
|
8卷引用:江西省南昌市第二中学2020-2021学年高二上学期第三次月考化学试题
6 . 根据下列实验操作及现象,能得出正确的结论的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A. | 向1mL2mol·L-1NaOH溶中加入2滴0.1mol·L-1MgCl2溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | 证明在相同温度下,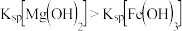 |
B. | 室温下,分别测饱和的 和 和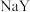 溶液的pH 溶液的pH |  和 和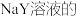 pH分别为8和9 pH分别为8和9 | 酸性: |
C. | 向2份等体积等浓度的稀硫酸中分别加入少量等物质的量的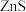 和 和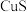 固体 固体 | 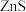 溶解而 溶解而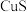 不溶解 不溶解 | 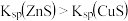 |
D. | 10mL,pH=4的HA溶液加水稀释至100mL | 稀释后溶液的pH=4.5 | HA为弱酸,该实验可 能是用pH试纸测的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-02-03更新
|
695次组卷
|
5卷引用:江西省南昌市第二中学2020-2021学年高二上学期期末考试化学试题
名校
7 . 下列实验能达到相应的实验目的的是
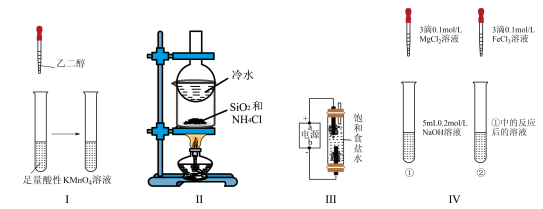

| A.I将乙二醇转化为乙二酸 |
| B.II分离SiO2和NH4Cl |
| C.III制备少量含NaClO的消毒液 |
| D.IV证明该温度下溶度积常数:Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
您最近一年使用:0次
2020-11-09更新
|
307次组卷
|
3卷引用:江西省南昌市第二中学2021届高三上学期第四次考试理综化学试题
名校
解题方法
8 . 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中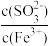 变化的曲线如图所示。
变化的曲线如图所示。

实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
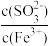 变化的曲线如图所示。
变化的曲线如图所示。
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
| A.检验a点溶液中反应生成的阴离子所需试剂为:稀硝酸和BaCl2溶液 |
B.c点和d点出现上述现象的主要原因是Fe3+和 发生双水解反应 发生双水解反应 |
C.b点较a点溶液pH升高的主要原因:2Fe3++ +H2O = 2Fe2++ +H2O = 2Fe2++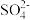 +2H+ +2H+ |
| D.向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+ |
您最近一年使用:0次
9 . 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
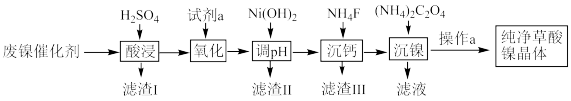
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________ 。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________ 。
(3)“调pH”时pH的调控范围为__________________ 。
(4)写出“沉镍”时发生反应的离子方程式:________________________________ ,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________ ,当Ca2+沉淀完全时,溶液中c(F-)>____________ mol·L-1(写出计算式即可)。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:
(3)“调pH”时pH的调控范围为
(4)写出“沉镍”时发生反应的离子方程式:
您最近一年使用:0次
2019-12-24更新
|
148次组卷
|
2卷引用:江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题
10 . 为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验分析不正确 的是( )
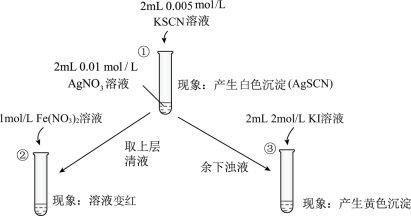

A.①浊液中存在平衡:AgSCN(s)  Ag+(aq)+SCN-(aq) Ag+(aq)+SCN-(aq) |
| B.②中颜色变化说明上层清液中含有SCN- |
| C.③中颜色变化说明有AgI生成 |
| D.该实验可以证明AgI比AgSCN更难溶 |
您最近一年使用:0次
2020-03-21更新
|
1357次组卷
|
32卷引用:江西省赣县第三中学2020-2021学年高二上学期12月月考化学试题
江西省赣县第三中学2020-2021学年高二上学期12月月考化学试题2017届北京市西城区普通中学高三上学期期中化学试卷北京市第101中学2017-2018学年高二下学期期末考试化学试题内蒙古通辽实验中学2018-2019学年高二上学期期中考试化学试题人教版高二化学选修4 第三章 第四节 难溶电解质的溶解平衡练习题【全国百强校】广东省深圳外国语学校2017-2018学年高二上学期期中化学试题(已下线)考点14 化学基本理论——《备战2020年高考精选考点专项突破题集》云南省玉溪第一中学2019-2020学年高二上学期第二次月考化学试题上海市十二校2016届高三3月联考化学试题北京清华附中2019—2020学年第二学期高二年级居家自主学习在线检测化学试卷北京清华附中2019-2020学年度第二学期高三化学统考试卷四川省成都市第七中学2021届高三上学期入学考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡福建省福州第三中学2019-2020学年高二上学期期末考试化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 教材帮河南省焦作市博爱县英才学校2020-2021学年高二上学期11月月考化学试题吉林省长春市实验中学2020-2021学年高二上学期期中考试化学试题山西省山西大学附属中学、汾阳中学2020-2021学年高二上学期12月月考化学试题吉林省长春市十一高中2020-2021学年高二上学期第三学程考试化学试题甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题(已下线)第10练 沉淀溶解平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)河南省开封市五县2021-2022学年高二上学期期末考试化学试题(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题(已下线)第八章 水溶液中的离子反应与平衡 第52讲 难溶电解质的溶解平衡黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期期末考试化学试题作业(二十一) 沉淀溶解平衡的应用第2课时 沉淀的溶解与生成、转化及应用(已下线)第5讲 难溶电解质的溶解平衡北京市第五十中学2022-2023学年高二上学期期中考试化学试题北京市第二十中学2021-2022学年高二上学期期中考试化学试卷黑龙江省哈尔滨市第四中学校2023-2024学年高二上学期11月月考化学试题



