2018·江西南昌·模拟预测
名校
1 . 下列说法正确的是( )
| A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B.SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3 |
| C.将Fe(NO3)3样品溶于稀硫酸后,滴加KSCN溶液,变红,不能说明样品变质 |
| D.室温下,SiO2(s)+3C(s) ═ SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0 |
您最近一年使用:0次
19-20高二上·江西南昌·期末
名校
2 . 根据下列实验操作和现象能得出相应结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向一定浓度CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S酸性比H2SO4强 |
| B | 向2mL0.1mol/LNaOH溶液中 1、滴加几滴浓度相同的MgSO4溶液,产生白色沉淀 2、再滴加几滴同浓度FeCl3溶液,产生红褐色沉淀 | 溶解度:Fe(OH)3<Mg(OH)2 |
| C | 常温下,相同铝片分别投入足量稀、浓硫酸中 | 反应物浓度越大,反应速率越大 |
| D | 取5 mL 0.1 mol⋅L−1KI溶液,加入1 mL 0.1 mol⋅L−1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
真题
名校
3 . 下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中 减小 减小 |
B.将CH3COONa溶液从20℃升温至30℃,溶液中 增大 增大 |
C.向盐酸中加入氨水至中性,溶液中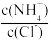 >1 >1 |
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 不变 不变 |
您最近一年使用:0次
2020-04-02更新
|
5595次组卷
|
44卷引用:江西省南昌市第二中学2017-2018学年高二上学期期末考试化学试题
江西省南昌市第二中学2017-2018学年高二上学期期末考试化学试题江西省南昌市八一中学、洪都中学等六校2019-2020学年高二上学期期末联考化学试题2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届四川省成都七中高三上学期10月阶段测化学卷2017届湖北省荆州中学高三上第四次质检化学试卷河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题湖北省荆州中学2018届高三第二次月考化学试题福建省福州市2016-2017学年高二上学期期中考试化学试题安徽省淮北市第一中学2017-2018学年高二上学期第四次月考(12月)化学试题河南省中原名校(即豫南九校)2017-2018学年高二上学期第二次联考化学试题天津市和平区2017-2018学年高二上学期期末考试化学试题天津市静海县第一中学2017-2018学年高二上学期期末终结性检测化学试题(已下线)《考前20天终极攻略》6月1日 专项一 四大平衡常数及其应用内蒙古北京八中乌兰察布分校2017-2018学年高二下学期第二次调研考试化学试题【全国校级联考】内蒙古赤峰市重点高中(赤峰二中,平煤高级中学等)2017-2018学年高二下学期期末联考(A)化学试题(已下线)解密13 沉淀溶解平衡——备战2018年高考化学之高频考点解密广东省蓝精灵中学2018-2019学年高二上学期联考化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)上学期期中考试化学试题吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题【全国百强校】内蒙古自治区鄂尔多斯市第一中学2018-2019学年高二下学期开学考试化学试题2016年全国普通高等学校招生统一考试化学(全国3卷参考版)云南省马关县二中2020届高三上学期开学考试化学试题河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题陕西省榆林市第二中学2019-2020学年高二上学期期中考试化学试题(已下线)专题8.3 盐类水解(练)-《2020年高考一轮复习讲练测》北京市2019—2020学年高二上学期期末考试模拟试题(选修4人教版 )2019—2020学年高二上学期化学期末复习—选择题专题训练一西藏自治区日喀则市南木林高级中学2020届高三上学期第四次月考理综化学试题重庆市云阳江口中学校2019-2020学年高二上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 水解平衡常数的应用(强化练习)重庆市江北中学2019-2020学年高二上学期期末模拟考试化学试题河南省南阳市2019-2020学年高二上学期期终质量评估化学试题安徽省黄山市2019-2020学年高二上学期期末质量检测 化学(理)试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训江西省吉安市省重点中学2020-2021学年高二上学期期中联合考试化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题河北省安平中学2019-2020学年高二上学期第四次月考化学试题(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)陕西省西安市长安区第一中学2017-2018学年高二上学期第四次教学质量检测化学试题江西省抚州市金溪县第一中学2021-2022学年高二下学期第二次月考化学试题江西省宜春市丰城市第九中学2023-2024学年高一下学期第一次月考化学试题(日新班)
2014高三·全国·专题练习
名校
解题方法
4 . 已知298K时下列物质的溶度积(单位略)
下列说法正确的是
| CH3COOAg | AgCl | Ag2CrO4 | Ag2S | |
| Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
| A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀 |
| B.离子浓度均为0.01 mol·L-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀 |
| C.在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式为:CH3COOAg+H++Cl-=CH3COOH+AgCl↓ |
| D.298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S) |
您最近一年使用:0次
2020-03-16更新
|
197次组卷
|
13卷引用:江西省南昌市新建县第一中学2019-2020学年高二上学期期末考试化学试题(共建部)
江西省南昌市新建县第一中学2019-2020学年高二上学期期末考试化学试题(共建部)江西省南昌市莲塘第一中学2019-2020学年高二上学期期末质量检测化学试题(已下线)2014年高考化学指导冲关 第6练水溶液中的离子平衡练习卷(已下线)2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化2016届河南省信阳市高三上学期期末质检化学试卷黑龙江省哈尔滨师范大学附属中学2017-2018学年高二上学期期中考试化学试题【全国百强校】内蒙古第一机械制造(集团)有限公司第一中学2018-2019学年高二上学期期中考试化学试题山东省兖州市2019-2020学年高二上学期期中考试化学试题河南省南阳市2017-2018学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——难容电解质的沉淀溶解平衡安徽省芜湖市2019-2020学年高二上学期期末考试化学(理)试题云南省玉溪市峨山一中2021—2022学年高二下学期3月月考化学试题浙江省杭州七县(市)地区及周边重点中学2022-2023学年高二下学期期中联考化学试题
名校
解题方法
5 . 常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )
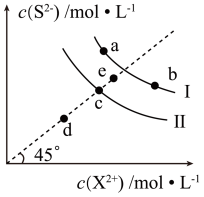

| A.曲线I表示MnS的沉淀溶解平衡曲线 |
| B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点 |
C.常温下,反应MnS(s)+Fe2+(aq) FeS(s)+Mn2+(aq)的平衡常数K≈4×104 FeS(s)+Mn2+(aq)的平衡常数K≈4×104 |
| D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动 |
您最近一年使用:0次
2020-02-22更新
|
533次组卷
|
8卷引用:江西省南昌市八一中学、洪都中学、南师附中、十七中四校2021-2022学年高二上学期期末联考化学考试试题
江西省南昌市八一中学、洪都中学、南师附中、十七中四校2021-2022学年高二上学期期末联考化学考试试题湖南省益阳市2019-2020学年高三上学期期末考试化学试题湖南省衡阳市一中2020届高三1月份期末联考理综化学试题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编宁夏六盘山高级中学2020届高三下学期第五次模拟测试理综化学试题(已下线)第21讲 难溶电解质的溶解平衡-2021年高考化学一轮复习名师精讲练(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)云南省大理市下关第一中学2023-2024学年高二下学期开学化学试题
10-11高三上·山东济南·阶段练习
名校
解题方法
6 . 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
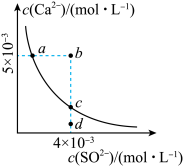

| A.在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
您最近一年使用:0次
2020-02-15更新
|
235次组卷
|
12卷引用:2016-2017学年江西省南昌二中高二上第二次考试化学卷
2016-2017学年江西省南昌二中高二上第二次考试化学卷(已下线)2011届山东省济南外国语学校高三上学期第三次质量检测化学试卷(已下线)2014届高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(已下线)2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷云南省文山州马关县实验高中2020届高三上学期开学考试化学试题云南省建水县第二中学2020届高三上学期开学考试化学试题2019年秋高三化学复习强化练习—— 与浓度积的相关计算夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——难溶电解质的沉淀溶解平衡(强化练习)云南省昭通市绥江县二中2019-2020学年高三上学期期末考试理综化学试题新疆哈密市第八中学2021-2022学年高二上学期期末考试化学试题云南省瑞丽市第一民族中学2021-2022学年高三下学期3月月考化学试题云南省楚雄彝族自治州民族中学2021-2022学年高三下学期3月月考化学试题
7 . 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
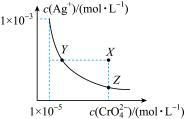

| A.t℃时,Ag2CrO4的Ksp为1×10-8 |
| B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀 |
您最近一年使用:0次
2020-02-06更新
|
1705次组卷
|
29卷引用:江西省南昌市安义中学2019-2020学年高二上学期期中考试化学试题
江西省南昌市安义中学2019-2020学年高二上学期期中考试化学试题(已下线)2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷2015-2016学年广东汕头金山中学高二上12月月考化学卷2015-2016学年山东寿光现代中学高二上12月月考化学卷2017届辽宁省大连市第二十高级中学高三12月月考化学试卷2016-2017学年陕西西安一中高二上月考二化学卷吉林省吉化第一高级中学校2017-2018学年高二上学期期末考试化学试题广东省中山市2017-2018学年高二上学期期末考试化学试题新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题重庆市万州第二高级中学2018-2019学年高二上学期期中考试化学试题吉林省长春市实验中学2018-2019学年高二下学期期末考试化学试题新疆霍城县江苏中学2018-2019学年高二上学期期末考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题【全国百强校】甘肃省静宁县第一中学2019-2020学年高二上学期第二次考试化学试题甘肃省甘谷第一中学2019-2020学年高二上学期第二次月考化学试题江西省上饶中学2019-2020学年高二上学期期中考试(特零班)化学试题云南省丽江市华坪县第一中学2019—2020学年高二上学期期末考试化学试题贵州省龙里中学2019-2020学年高二上学期期末考试化学试题山东省济南市章丘区第四中学2019-2020学年高二下学期第一次月考化学试题河北省衡水市枣强中学2019-2020学年高二下学期第一次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二(实验班)12月月考化学试题山东省枣庄市滕州市第一中学2019-2020高二上学期期末考试化学试题重庆市缙云教育联盟2020-2021学年高二上学期10月月考化学试题河北省石家庄市辛集市第一中学2019-2020学年高二上学期第三次月考化学试题吉林省洮南市第一中学2020-2021学年高二上学期期中考试化学试题山东省济南市济阳区闻韶中学2020-2021学年高三(3班)12月第一次模拟考试化学试题四川省峨眉第二中学校2021-2022学年高二下学期5月月考化学试题宁夏石嘴山第三中学2021-2022学年高二下学期期末考试化学试题辽宁省重点高中沈阳市郊联体2022-2023学年高二上学期期末考试化学试题
12-13高二下·江西抚州·期末
名校
8 . 如表为有关化合物的pKsp,pKsp=-lgKsp。某同学设计实验如下:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY;③向②中加入NaZ,沉淀又转化为AgZ。则表中a、b、c的大小关系为
| 相关化合物 | AgX | AgY | AgZ |
| pKsp | a | b | c |
| A.a>b>c | B.a<b<c | C.c<a<b | D.a+b=c |
您最近一年使用:0次
2020-01-16更新
|
485次组卷
|
7卷引用:江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题
江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题(已下线)2012-2013学年江西省抚州市高二下学期期末考试化学试卷广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题江西省上高县第二中学2017-2018学年高二上学期期末考试化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下学期期末考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二上学期期末考试化学试题(已下线)第5讲 难溶电解质的溶解平衡
名校
9 . 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lg c(SO42-)。下列说法正确的是( )
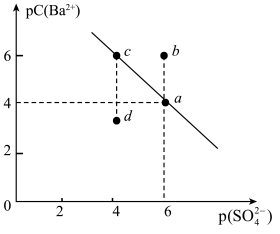

| A.加入BaCl2可以使溶液由c点变到a点 |
| B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4) |
| C.d点表示的是该温度下BaSO4的不饱和溶液 |
| D.该温度下,Ksp(BaSO4)=1.0×10-24 |
您最近一年使用:0次
2020-01-15更新
|
422次组卷
|
14卷引用:江西省南昌市第二中学2017-2018学年高二上学期第三次月考化学试题
江西省南昌市第二中学2017-2018学年高二上学期第三次月考化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期期末考试化学试题2014-2015湖北省襄阳市五中高二3月月考化学试卷2015-2016学年河南省南阳一中高二下期末模拟化学试卷河南省驻马店市2016-2017学年高二下学期期末考试化学试题湖北省荆门市2016-2017学年高二下学期期末质量检测化学试题四川省石室中学2017-2018学年高二上学期半期考试化学试题江西省横峰中学2017-2018学年高二上学期第三次月考化学试题【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷云南省玉溪第一中学2019-2020学年高二上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——沉淀溶解平衡的曲线分析江西省赣县第三中学2020-2021学年高二上学期12月月考化学试题(已下线)题型27 沉淀溶解平衡常数及其应用图象
名校
解题方法
10 . 以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为____________ (填化学式)而除去.
(2)①中加入的试剂应该选择________ 为宜,其原因是__________ .
(3)②中除去Fe3+所发生的总反应的离子方程式为______________________________ .
(4)下列与方案③相关的叙述中,正确的是______ (填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜或氧化铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为
(2)①中加入的试剂应该选择
(3)②中除去Fe3+所发生的总反应的离子方程式为
(4)下列与方案③相关的叙述中,正确的是
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜或氧化铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
您最近一年使用:0次



