名校
1 . 下表中的实验操作不能达到实验目的或得出相应结论的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,完全反应后收集H2的体积 | 比较两种酸的电离程度 |
| B | 将混有Ca(OH)2杂质的 Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀。 | 除去Mg(OH)2样品中的Ca(OH)2杂质 |
| C | 向盛有1mL0.01mol/LAgNO3溶液的试管中滴加5滴0.01mol/L NaCl溶液,有白色沉淀生成,再滴加0.01mol/L NaI溶液,产生黄色沉淀。 | 常温下,Ksp(AgCl)>Ksp(AgI) |
| D | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5 | HSO3-结合H+的能力比SO32-的弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列离子方程式正确的是
A.将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| B.用FeS去除废水中的Hg2+:Hg2+ + S2- === HgS↓ |
| C.AlCl3溶液与Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓ |
D.NH4Cl溶于D2O中显酸性:NH4++D2O NH3·HDO+D+ NH3·HDO+D+ |
您最近一年使用:0次
2019-01-01更新
|
288次组卷
|
2卷引用:【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期第三次月考化学试题
名校
解题方法
3 . 下列实验不能达到预期实验目的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-12-23更新
|
656次组卷
|
4卷引用:【校级联考】江西省南昌市八一中学、洪都中学等七校2018-2019学年高二上学期期末考试化学试题
4 . 在常温下Cu(OH)2的Ksp=2×10-20,某CuSO4溶液中,c(Cu2+)=0.02mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱来调整pH,使溶液的pH大于
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2018-11-28更新
|
389次组卷
|
19卷引用:江西省南昌市第十中学2020-2021学年高二上学期第二次月考化学试题
江西省南昌市第十中学2020-2021学年高二上学期第二次月考化学试题2014-2015湖南省浏阳市高二上学期理科化学试卷2014-2015山西省太原市五中高二上学期期末化学理试卷2016-2017学年吉林省吉林二中高二上学期9月月考化学试卷2016-2017学年辽宁省沈阳铁路中学高二上期中化学试卷福建省华安一中2016-2017学年高二上学期期末考化学试卷2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷内蒙古巴彦淖尔市第一中学2017-2018学年高二12月月考化学试题(B卷)内蒙古巴彦淖尔市第一中学2017-2018学年高二12月月考化学试题(A卷)甘肃省天水市第一中学2017-2018学年高二下学期入学考试化学试题河北省定州中学2017-2018学年高二下学期第一次月考化学试题人教版高二化学选修4 第三章 第四节 难溶电解质的溶解平衡练习题湖南省长沙市第一中学、师大附中2019—2020学年高二上学期期末联考化学试题四川省绵阳南山中学实验学校2019-2020学年高二下学期开学考试化学试题四川省南充市营山第二中学2019-2020学年高二下学期4月考试化学试题河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题重庆市秀山高级中学校2020-2021学年高二上学期10月月考化学试题宁夏银川市第二中学2021-2022学年高二下学期期中考试化学试题【精品卷】3.4.2 沉淀溶解平衡的应用-人教版2023-2024学年选择性必修1
名校
解题方法
5 . Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O 2HCrO4
2HCrO4 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______ 性,在强碱溶液中,铬元素的主要存在形式为________ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______ (填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是________ ,上述四种离子浓度的大小顺序为________ (选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________ ;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______ c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
(1)你认为往废水中投入________________ (填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______ 。
Cr2O72-+H2O
 2HCrO4
2HCrO4 2CrO42-+2H+
2CrO42-+2H+(1)重铬酸钾溶液呈
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是
(2)若上述关系中③是正确的,则溶液中的溶质为
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
您最近一年使用:0次
2018-11-19更新
|
417次组卷
|
2卷引用:江西省南昌市八一中学2018-2019学年高二上学期12月月考化学试题
名校
6 . 下列有关化学实验操作,现象和结论均为正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | Mg2+和Cu2+共存的溶液中滴入适量NaOH溶液 | 产生白色沉淀 | 相同温度下,溶度积常数: Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
| B | 直接给石蜡油加热,气体通过酸性高锰酸钾溶液中 | 溶液逐渐褪色 | 验证石蜡油裂解一定生成乙烯 |
| C | 常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液 | 碳酸钠溶液中红色更深 | 阴离子水解常数Kh: CO32->HCO3- |
| D | 向饱和硼酸溶液中滴加少量Na2CO3粉末 | 无气泡冒出 | 不能证明酸性:碳酸>硼酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-06-03更新
|
1434次组卷
|
5卷引用:江西省南昌市南昌县莲塘第一中学2021届高三上学期12月质量检测化学试题
7 . 下列由实验得出的结论正确的是
| 选项 | 实验 | 结论 |
| A | 向某钠盐中滴加浓盐酸。将产生的气体通入品红溶液,品红溶液褪色 | 该钠盐为Na2SO3或NaHSO3 |
| B | 用乙酸浸泡水壶中的水垢。可将其清除 | 乙酸的酸性大于碳酸 |
| C | 向某盐溶液中先加入少量氯水、再滴加几滴KSCN溶液,溶液变血红色 | 原溶液中一定含有Fe2+ |
| D | 室温下。向饱和Na2CO3溶液中加入少量BaSO4粉末。过滤,向洗净的沉淀中加稀盐酸有气泡产生 | Ksp(BaCO3)< Ksp(BaSO4) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-04-28更新
|
530次组卷
|
7卷引用:江西省南昌市第十中学2020-2021学年高二上学期第二次月考化学试题
名校
8 . 下列实验事实得出的相应结论不正确的是
| 选项 | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
| C | 2NO2(g) N2O4(g),加压气体颜色加深 N2O4(g),加压气体颜色加深 | 加压平衡向着气体颜色加深的方向移动 |
| D | 将MgCl2溶液蒸干后灼烧,得到MgO固体 | 蒸干的过程中水解生成的HCl挥发,水解进一步促进生成Mg(OH)2,灼烧后产生MgO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-03-27更新
|
661次组卷
|
8卷引用:江西省南昌市八一中学、洪都中学等六校2019-2020学年高二上学期期末联考化学试题
江西省南昌市八一中学、洪都中学等六校2019-2020学年高二上学期期末联考化学试题合肥八中、阜阳一中2017-2018学年第一学期高二年级期末考试化学试题河北省定州中学2017-2018学年高二(承智班)下学期第一次月考化学试题河北省沧州市盐山中学2019-2020学年高二上学期期末考试(B)化学试题安徽省淮北市树人高级中学2020-2021学年高二下学期第一次阶段考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)重庆市朝阳中学2021-2022学年高二12月月考化学试题山东省德州市第一中学2021-2022学年高二12月月考化学试题
名校
9 . 下列实验描述、对应的现象以及结论都正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向滴有酚酞的Na2CO3溶液中加入BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| B | 处理锅炉水垢中的CaSO4 时,依 次加入饱和Na2CO3溶液和盐酸 | 水垢溶解 | Ksp:CaCO3>CaSO4 |
| C | 其它条件不变,平衡体系: FeCl3(aq)+3KSCN(aq)  Fe(SCN)3(aq)+3KCl(aq)中,加KCl 固体 Fe(SCN)3(aq)+3KCl(aq)中,加KCl 固体 | 红色变浅 | 证明增大生成物KCl的浓度,使原溶液中化学平衡逆向移动 |
| D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp:AgCl<AgI |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-01-17更新
|
183次组卷
|
2卷引用:江西省南昌市八一中学2018-2019学年高二上学期12月月考化学试题
10 . 一定温度下,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=−lgc(M),p(CO32−)=−lgc(CO32−)。已知ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是
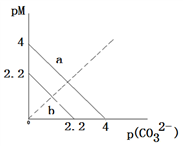

| A.线a表示ACO3的溶解平衡曲线 |
| B.该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀 |
| C.向0.1L 1mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6g时,B2+离子恰好沉淀完全(B2+离子为10—5mol/L时认为沉淀完全) |
| D.ACO3的Ksp=10—4.4 |
您最近一年使用:0次
2018-01-11更新
|
1103次组卷
|
3卷引用:【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期第三次月考化学试题



