1 . 25 ℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
 Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是| A.若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大 |
| B.若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动 |
| C.若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色 |
| D.若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大 |
您最近一年使用:0次
2020-05-18更新
|
286次组卷
|
12卷引用:四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题
四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题苏教版高三单元精练检测八化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(普通班)上学期期末考试化学试题吉林省四平市双辽市第二中学2019-2020学年高二上学期期末考试化学试题山西省太原市山西省实验中学2019-2020学年高二上学期12月月考化学试题广西南宁市第三中学2019-2020学年高二下学期期中段考化学试题广西桂林市第十八中学2020-2021学年高二下学期期中考试化学试题吉林省抚松县第一中学2021-2022学年高二上学期第三次月考化学试题福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第52练 难溶电解质的溶解平衡江西省宜春市丰城中学2022-2023学年高二上学期期末考试化学试题新疆实验中学2023-2024学年高二上学期期中考试化学试题
名校
2 . 下列实验及现象不能得出相应结论的是
| 选项 | 实验 | 现象 | 结论 |
| A | 某溶液中滴加K3[(Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有 Fe2+ |
| B | 将CO2依次通过 NaHSO3溶液、品红溶液 | 品红溶液不褪色 | H2SO3的酸性强于比H2CO3 |
| C | 向 l mL 新制氢氧化铜悬浊液中滴加适量 10 %葡萄糖溶液,加热煮沸 | 产生砖红色沉淀 | 葡萄糖具有还原性 |
| D | 向 lmL0. l mol/L AgNO3溶液中滴加4~5 滴 0.l mol/L KI 溶液,再滴加几滴 0. 1mo l/L Na2S 溶液 | 先有黄色沉淀生成;后又有黑色沉淀 | Ksp (AgI )> Ksp (Ag2S) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-05-18更新
|
369次组卷
|
2卷引用:四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题
解题方法
3 . 常温下,Ksp(CaCO3)=2.8×10-9,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是


| A.a点是CaSO4的饱和溶液而b点不是 |
| B.蒸发水可使溶液由b点变化到a点 |
C.常温下,CaCO3(s)+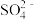 (aq) (aq) CaSO4(s)+ CaSO4(s)+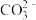 (aq)的K=3.1×10-4 (aq)的K=3.1×10-4 |
| D.除去锅炉中的CaSO4时,可用Na2CO3溶液将其转化为CaCO3 |
您最近一年使用:0次
2020-05-17更新
|
501次组卷
|
6卷引用:四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题
四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题河南省焦作市2020届高三第三次模拟考试理综化学试题河南省安阳市2020届高三第二次模拟考试理科综合化学试题河北省石家庄市正中实验中学东校区2022-2023学年高二上学期10月月考化学试题(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)第6讲 沉淀溶解平衡图像分析
名校
解题方法
4 . 根据下列实验或实验操作和现象,所得结论正确的是( )
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| B | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2比Fe3+强 |
| C | 向盛有0.1mol/L的MgCl2溶液的试管中滴加几滴2mol/LNaOH溶液,再滴加几滴0.1mol/L的FeCl3溶液 | 先有白色沉淀生成,后沉淀又转化为红褐 色 | 此温度下:Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
| D | 向Ba(NO3)2溶液中缓缓通入SO2气体 | 有白色沉淀生成 | 生成了BaSO3沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 下列说法正确的是( )
| A.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 |
| B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,再用水稀释到所需的浓度 |
| C.Na2CO3溶液保存在带磨口塞的玻璃瓶中 |
| D.用pH试纸测的0.1mol/LNH4Cl溶液的pH=5.2 |
您最近一年使用:0次
名校
解题方法
6 . 根据下列实验及其现象,所得出的结论合理的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向 溶液中滴入几滴 溶液中滴入几滴  溶液,再滴加几滴 溶液,再滴加几滴  溶液 溶液 | 先有白色沉淀生成,后有蓝色絮状沉淀生成 | Ksp: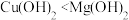 |
| B | 用pH试纸分别检验等浓度 溶液和 溶液和 溶液 溶液 | 前者试纸变蓝比后者更深些 | 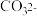 水解能力强于 水解能力强于 |
| C | 分别加热蒸干 溶液和 溶液和 溶液 溶液 | 前者能得到 固体;后者得不到 固体;后者得不到 固体 固体 |  不易挥发, 不易挥发, 易挥发 易挥发 |
| D | 向某钠盐中滴加盐酸,产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐为 或 或 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 某水样中含有较多剧毒离子,实验室中加入过量FeS固体,可使转化为CdS沉淀除去。据此可推知下列说法正确的是( )
| A.水中的溶解度:FeS>CdS |
| B.溶解平衡常数Ksp:FeS<CdS |
| C.FeS具有较强的吸附能力 |
| D.CdS难溶于任何溶液 |
您最近一年使用:0次
2020-05-10更新
|
245次组卷
|
3卷引用:四川省成都市蓉城名校联盟2019-2020学年高二上学期期末联考化学试题
名校
8 . 根据下列实验操作和现象,得出的结论及推理均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 光照时甲烷与氯气反应后的混合气体能使紫色石蕊溶液变红 | 生成的氯甲烷具有酸性 |
| B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X一定具有氧化性 |
| C | 两支盛0.1 mol·L−1 醋酸和次氯酸的试管中分别滴加等浓度NaHCO3溶液,观察到前者有气泡、后者无气泡 | Ka(CH3COOH)>Ka1(H2CO3)>Ka(HClO) |
| D | 向10 mL0.1 mol·L−1 AgNO3 溶液中先加入0.1 mol·L−1 KCl 溶液5 mL,再加入0.1 mol·L−1 的KI溶液5 mL,先出现白色沉淀,后出现黄色沉淀。 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-05-04更新
|
155次组卷
|
2卷引用:四川省南充高级中学2020届高三下学期4月月考理综化学试题
名校
解题方法
9 . 工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法正确的是
CuS(s)+Mn2+(aq),下列说法正确的是
 CuS(s)+Mn2+(aq),下列说法正确的是
CuS(s)+Mn2+(aq),下列说法正确的是| A.该反应达到平衡时,c(Mn2+)=c(Cu2+) |
| B.该反应达到平衡时,Ksp(CuS)较大 |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)减小 |
D.该反应的平衡常数K= |
您最近一年使用:0次
2020-04-15更新
|
117次组卷
|
2卷引用:四川省绵阳南山中学实验学校2019-2020学年高二下学期开学考试化学试题
名校
解题方法
10 . (1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是____ (填“I”或“II”)。
②V1和V2的关系:V1____ V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是____ 。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
①写出步骤2中溶液变红色的离子方程式____ 。
②步骤3中现象a是____ 。
③用化学平衡原理解释步骤4的实验现象____ 。

①滴定醋酸的曲线是
②V1和V2的关系:V1
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
| 操作步骤 | 现象 |
| 步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/LKSCN溶液,静置。 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴mol/LFe(NO3)3溶液。 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅 |
| 步骤4:向步骤1中余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀 |
②步骤3中现象a是
③用化学平衡原理解释步骤4的实验现象
您最近一年使用:0次



