名校
1 . 铁氰化钾( )是一种氰配合物,易溶于水,可检验
)是一种氰配合物,易溶于水,可检验 。某研究性学习小组拟制备铁氰化钾并探究其性质。
。某研究性学习小组拟制备铁氰化钾并探究其性质。
(1)制备铁氰化钾。用 氧化
氧化 制备
制备 ,装置如图所示。
,装置如图所示。________ 。实验测得石墨电极上生成 的体积小于Cu电极上生成气体的体积,其原因可能是
的体积小于Cu电极上生成气体的体积,其原因可能是________ 。
②装置B中发生反应的化学反应方程式为________ 。
(2)探究铁氰化钾的性质。查阅资料,提出猜想:
猜想1: 具有氧化性;
具有氧化性;
猜想2: 溶液中存在化学平衡
溶液中存在化学平衡 。
。
设计如下实验展开探究(本实验所用蒸馏水均已除氧:已知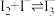 )。
)。
①铁氰化钾晶体中各种微粒间的相互作用不包括________ (填编号)。
a.离子键 b.共价键 c.配位键
d.金属键 e. 键 f.范德华力
键 f.范德华力
②实验Ⅱ可以证明猜想1成立。实验Ⅰ中滴加淀粉溶液后不变蓝的原因可能是________ 。
③利用平衡移动原理解释实验Ⅲ中加入浓盐酸后溶液变为红色的原因:________ 。
④由实验Ⅲ、Ⅳ、Ⅴ的信息,小组同学认为猜想2成立。实验Ⅳ、Ⅴ中判断猜想2成立的依据是________ 。
(3)铁氰化钾可用于测定硫酸钴晶体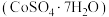 中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入
中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入 mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液
mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液 mL。反应的方程式为
mL。反应的方程式为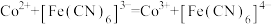 。样品中钴的含量
。样品中钴的含量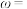
________ (以钴的质量分数ω计)
(4)铁盐或亚铁盐应用广泛,写出其中一种的化学式并写出该盐的一种用途________ 。
 )是一种氰配合物,易溶于水,可检验
)是一种氰配合物,易溶于水,可检验 。某研究性学习小组拟制备铁氰化钾并探究其性质。
。某研究性学习小组拟制备铁氰化钾并探究其性质。(1)制备铁氰化钾。用
 氧化
氧化 制备
制备 ,装置如图所示。
,装置如图所示。
 的体积小于Cu电极上生成气体的体积,其原因可能是
的体积小于Cu电极上生成气体的体积,其原因可能是②装置B中发生反应的化学反应方程式为
(2)探究铁氰化钾的性质。查阅资料,提出猜想:
猜想1:
 具有氧化性;
具有氧化性;猜想2:
 溶液中存在化学平衡
溶液中存在化学平衡 。
。设计如下实验展开探究(本实验所用蒸馏水均已除氧:已知
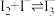 )。
)。| 实验 | 实验操作 | 实验现象 |
| Ⅰ | 向2mL饱和KI溶液中滴加5~6滴  溶液,振荡,再滴加几滴淀粉溶液 溶液,振荡,再滴加几滴淀粉溶液 | 无明显现象 |
| Ⅱ | 向2mL  溶液中滴加5~6滴饱和KI溶液,振荡,再滴加几滴淀粉溶液 溶液中滴加5~6滴饱和KI溶液,振荡,再滴加几滴淀粉溶液 | 溶液变成蓝色 |
| Ⅲ |   溶液中滴入几滴KSCN溶液,再向溶液中加入少量浓盐酸 溶液中滴入几滴KSCN溶液,再向溶液中加入少量浓盐酸 | 滴入KSCN溶液,无明显现象,加入盐酸后,溶液变红 |
| Ⅳ | 向浓度均为  、 、 的混合溶液中放入一根无锈铁丝 的混合溶液中放入一根无锈铁丝 |  产生蓝色沉淀 产生蓝色沉淀 |
| Ⅴ | 向  溶液中放入一根无锈铁丝(与实验Ⅳ铁丝相同) 溶液中放入一根无锈铁丝(与实验Ⅳ铁丝相同) | 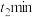 产生蓝色沉淀 产生蓝色沉淀 |
a.离子键 b.共价键 c.配位键
d.金属键 e.
 键 f.范德华力
键 f.范德华力②实验Ⅱ可以证明猜想1成立。实验Ⅰ中滴加淀粉溶液后不变蓝的原因可能是
③利用平衡移动原理解释实验Ⅲ中加入浓盐酸后溶液变为红色的原因:
④由实验Ⅲ、Ⅳ、Ⅴ的信息,小组同学认为猜想2成立。实验Ⅳ、Ⅴ中判断猜想2成立的依据是
(3)铁氰化钾可用于测定硫酸钴晶体
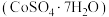 中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入
中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入 mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液
mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液 mL。反应的方程式为
mL。反应的方程式为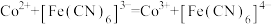 。样品中钴的含量
。样品中钴的含量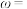
(4)铁盐或亚铁盐应用广泛,写出其中一种的化学式并写出该盐的一种用途
您最近一年使用:0次
名校
解题方法
2 . 铅用途广泛,是电气工业部门制造蓄电池、汽油添加剂和电缆的原材料。工业上常用铅精矿(主要成分是PbS以及少量Zn、Fe、SiO2、MgO、Al2O3)通过如图所示工业流程制取铅。

已知:①PbS在稀硫酸中不会溶解
②常温下,相关金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)滤渣1的成分是___________ ;酸浸后的分离操作是___________ 。
(2)溶液3可以是___________。
(3)反应4中铅单质在___________ 极产生,对应的电极反应式为___________ ;若转移2 mol电子,则生成的铅___________ 克。
(4)已知溶液4的溶质是化合物且为绿色氧化剂,写出反应3的化学方程式___________ 。
(5)根据题目所给信息,请计算出
___________ 。

已知:①PbS在稀硫酸中不会溶解
②常温下,相关金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.5 | 2.2 | 5.4 | 9.5 | 3.5 |
完全沉淀( )的pH )的pH | 9.7 | 3.2 | 6.4 | 11.0 | 4.7 |
(1)滤渣1的成分是
(2)溶液3可以是___________。
| A.盐酸 | B.氢氧化钠溶液 | C.食盐水 | D.氯化铵溶液 |
(3)反应4中铅单质在
(4)已知溶液4的溶质是化合物且为绿色氧化剂,写出反应3的化学方程式
(5)根据题目所给信息,请计算出

您最近一年使用:0次
名校
解题方法
3 . 碲在冶金工业中用途广泛,被誉为现代工业的维生素。某精炼铜的阳极泥经过处理后的主要成分为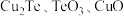 等,从中回收碲和胆矾的工艺如下:
等,从中回收碲和胆矾的工艺如下:

已知:①高温熔烧后的产物为 和
和 ;
;
② 在酸性条件下会发生歧化反应;
在酸性条件下会发生歧化反应;
③ 元素在酸化和碱浸后分别转化为
元素在酸化和碱浸后分别转化为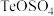 和
和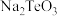
两种易溶于水的盐 。
回答下列问题:
(1)“高温焙烧”时,从结构的角度分析 的产物是
的产物是 而不是
而不是 的原因为
的原因为___________ 。
(2)“酸化”时还需要加入一定量的 ,其目的是
,其目的是___________ 。
(3)“还原”时发生反应的离子方程式为___________ 。
(4)碱浸后铜元素的存在形式为___________ (写化学式)。
(5)“电解”制 的原理如图,其中N与电源的
的原理如图,其中N与电源的___________ (填“正极”或“负极”)相连:与M相连的惰性电极上发生电极反应式为___________ 。

(6)胆矾的结构如图所示。下列说法正确的是___________。

(7) 的立方晶胞结构如图。其中
的立方晶胞结构如图。其中 的配位数为
的配位数为___________ ;已知晶胞边长为 ,
, 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。

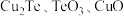 等,从中回收碲和胆矾的工艺如下:
等,从中回收碲和胆矾的工艺如下:
已知:①高温熔烧后的产物为
 和
和 ;
;②
 在酸性条件下会发生歧化反应;
在酸性条件下会发生歧化反应;③
 元素在酸化和碱浸后分别转化为
元素在酸化和碱浸后分别转化为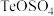 和
和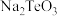
回答下列问题:
(1)“高温焙烧”时,从结构的角度分析
 的产物是
的产物是 而不是
而不是 的原因为
的原因为(2)“酸化”时还需要加入一定量的
 ,其目的是
,其目的是(3)“还原”时发生反应的离子方程式为
(4)碱浸后铜元素的存在形式为
(5)“电解”制
 的原理如图,其中N与电源的
的原理如图,其中N与电源的
(6)胆矾的结构如图所示。下列说法正确的是___________。

| A.胆矾晶体中含有离子键、配位键、氢键等化学键 | B.胆矾属于离子晶体 |
C. 的空间结构为正四面体形 的空间结构为正四面体形 | D.电负性O>S,第一电离能 |
 的立方晶胞结构如图。其中
的立方晶胞结构如图。其中 的配位数为
的配位数为 ,
, 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2023-06-22更新
|
475次组卷
|
3卷引用:广东省汕头市潮阳区2023届高三下学期三模化学试题
解题方法
4 . 金属钴(Co)广泛用作电池材料,草酸钴用途广泛,可用于指示剂和催化剂制备。
某工厂以水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备草酸钴的流程如图,回答下列问题:
等)为原料制备草酸钴的流程如图,回答下列问题:

(1) 中钴元素显+2价,则碳元素的化合价为
中钴元素显+2价,则碳元素的化合价为___________ ,固体1的成分是___________ 。
(2)酸浸过程涉及两个氧化还原反应,写出 与盐酸反应(有气体单质生成)的离子方程式:
与盐酸反应(有气体单质生成)的离子方程式:___________ ,另一个反应中氧化剂与还原剂(均指固体)物质的量之比为___________ 。
(3)为实现调pH除杂的目的(溶液中杂质离子浓度不大于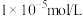 ,溶液的pH不应小于a,则所得固体1的
,溶液的pH不应小于a,则所得固体1的
___________ ,用NaF沉镁而不是用调pH的方法除镁的原因最可能是___________ {已知常温下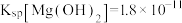 、
、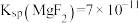 }。
}。
(4) 在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g
在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g 充分加热后,固体质量减少8.8g,写出相应的化学方程式:
充分加热后,固体质量减少8.8g,写出相应的化学方程式:___________ 。
(5)钴酸锂具有功率大的特点而用作电动汽车的动力电池,其工作原理如图,A极中的碳作为金属锂的载体,电池反应式: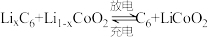 。
。
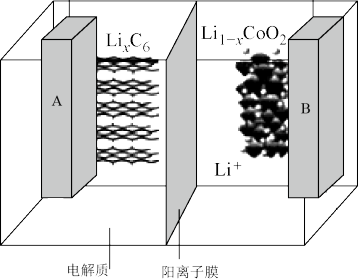
则充电时 从
从___________ (填“A”或“B”)极区移向另一区,阳极上的电极反应式为___________ 。
某工厂以水钴矿(主要成分为
 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备草酸钴的流程如图,回答下列问题:
等)为原料制备草酸钴的流程如图,回答下列问题:
(1)
 中钴元素显+2价,则碳元素的化合价为
中钴元素显+2价,则碳元素的化合价为(2)酸浸过程涉及两个氧化还原反应,写出
 与盐酸反应(有气体单质生成)的离子方程式:
与盐酸反应(有气体单质生成)的离子方程式:(3)为实现调pH除杂的目的(溶液中杂质离子浓度不大于
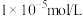 ,溶液的pH不应小于a,则所得固体1的
,溶液的pH不应小于a,则所得固体1的
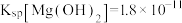 、
、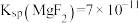 }。
}。(4)
 在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g
在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g 充分加热后,固体质量减少8.8g,写出相应的化学方程式:
充分加热后,固体质量减少8.8g,写出相应的化学方程式:(5)钴酸锂具有功率大的特点而用作电动汽车的动力电池,其工作原理如图,A极中的碳作为金属锂的载体,电池反应式:
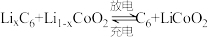 。
。
则充电时
 从
从
您最近一年使用:0次
解题方法
5 . 氮化镓(GaN)在5G基站及工业互联网系统建设等方面用途广泛。从砷化镓废料(主要成分为GaAs,含Fe2O3、 SiO2和CaCO3等杂质)中回收砷,制备GaN的工艺流程如图:
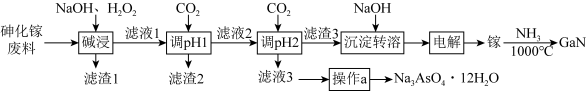
已知:①Ga与Al同主族,化学性质相似;
②离子完全沉淀的pH值: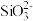 为8,
为8, 为5.5。
为5.5。
回答下列问题:
(1)为了提高“碱浸”效率应采用的措施是_______ (写 出一种措施)。
(2)“滤液1”中含有NaGaO2等溶质, “碱浸”时反应的离子方程式为_______ 。“滤渣1”的成分为_______ (填化学式)。
(3)通CO2两次调pH的原因是_______ 。
(4)“操作a”为_______ 、过滤、洗涤、干燥。
(5)“电解”时阴极的电极反应为_______ 。
(6)制备GaN时,参与反应的氧化剂与还原剂的物质的量之比为_______ 。
(7)取m克GaN样品溶于足量的热NaOH溶液(GaN+OH- +H2O = +NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是
+NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是_______ 。(已知: NH3+H3BO3 =NH3·H3BO3;NH3·H3BO3 +HCl=NH4Cl+H3BO3 )

已知:①Ga与Al同主族,化学性质相似;
②离子完全沉淀的pH值:
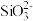 为8,
为8, 为5.5。
为5.5。回答下列问题:
(1)为了提高“碱浸”效率应采用的措施是
(2)“滤液1”中含有NaGaO2等溶质, “碱浸”时反应的离子方程式为
(3)通CO2两次调pH的原因是
(4)“操作a”为
(5)“电解”时阴极的电极反应为
(6)制备GaN时,参与反应的氧化剂与还原剂的物质的量之比为
(7)取m克GaN样品溶于足量的热NaOH溶液(GaN+OH- +H2O =
 +NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是
+NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是
您最近一年使用:0次
名校
解题方法
6 . 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:还原性Fe>Ni>Cu)
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中有Cu和Pt |
您最近一年使用:0次
2022-08-15更新
|
1456次组卷
|
119卷引用:广东省惠州市惠东县惠东高级中学2018-2019学年高二上学期10月月考化学试题
广东省惠州市惠东县惠东高级中学2018-2019学年高二上学期10月月考化学试题(已下线)浙江省临海市白云中学2009—2010学年度高二下学期第一次月考化学试题(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011届福建省三明一中高三上学期期中考试化学卷(已下线)2011届山东省济南外国语学校高三上学期第三次质量检测化学试卷(已下线)2010-2011学年江苏省南京六中高二下学期期末考试化学试题(已下线)2011-2012学年山东省潍坊市高二寒假作业化学(一)试卷(已下线)2011-2012学年福建南平政和一中高二期末考试化学试卷(已下线)2011-2012学年天津市耀华中学高二上学期期末考试化学试卷(已下线)2011-2012学年陕西省师大附中高一下学期期末考试化学试卷(已下线)2013届江苏省泰州中学高三上学期期中考试化学试卷(已下线)2013届山东省济宁市鱼台一中高三上学期期中考试化学试卷(已下线)2014高考名师推荐化学电解三池的应用(已下线)2013-2014天津市耀华中学高二上学期期末考试化学试卷(已下线)2015安徽望江中学同步课时练(人教选修4)第四章检测试卷2014-2015四川省重点中学高二下学期期中考试化学试卷2015-2016学年福建省四地六校高二上学期10月联考化学试卷2015-2016学年福建省四地六校高二上学期10月一次联考化学试卷2016届湖南省十校共同体高三上学期12月联考化学试卷2015-2016学年河北省故城高级中学高二上12月月考化学试卷2016届山东省菏泽一中高三上学期12月月考化学试卷2015-2016学年吉林省延边三中高二上12月月考化学试卷2017届山东省滕州市第二中学高三上学期10月月考化学试卷2017届甘肃省天水一中高三上学期第一次月考化学卷2016-2017学年福建省四地六校高二上第一次月考化学试卷(已下线)同步君 选修4 第4章 第3节 电解原理的应用2016-2017学年河北石家庄一中高二上期中考试化学试卷2016-2017学年黑龙江哈尔滨六中高二上期末化学卷2016-2017学年江苏省如东高级中学高一下学期第一次(3月)阶段检测化学试卷福建省龙海市程溪中学2016-2017学年高二下学期期末考试化学试题山东省寿光现代中学2017-2018学年高二上学期开学考试化学试题河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题河北省承德市第一中学2017-2018学年高二上学期第一次月考化学试题山东省垦利第一中学2017-2018学年高二上学期第一次月考化学试题四川省成都经开区实验中学2018届高三10月月考理综化学试题安徽省蚌埠市第二中学2017-2018学年高二上学期期中考试化学试题山东省菏泽市2017-2018学年高二上学期期中考试(B)化学试题高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第二课时(电解原理的应用)陕西师范大学附中2017-2018第一学期高二年级化学期中考试化学试题天津市红桥区2017-2018学年高二上学期期末考试化学试题河南省豫南九校2017-2018学年高二上学期期末联考化学试题1河南省豫南九校2017-2018学年高二上学期期末联考化学试题2河北省承德市第二中学2017-2018学年高二上学期第一次月考化学试题2018-2019学年鲁科版高中化学选修四:第1章检测题河南省镇平县第一高级中学2018-2019学年高二上学期第一次月考化学试题吉林省辽源市田家炳高级中学2018-2019学年高二9月月考化学试题山东省鄄城市第一中学2018-2019学年高二上学期第一次月考化学试题陕西省黄陵中学2018-2019学年高二(重点班)上学期期中考试化学试题高二人教版选修4 第四章 第三节 电解池山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题(已下线)考点10 电解原理 金属的腐蚀与防护——备战2019年浙江新高考化学考点四川省遂宁市2018-2019学年高二下学期期末考试化学试题云南省普洱市澜沧县民族中学2018-2019学年高二下学期期末考试化学试题四川省武胜县烈面中学校2018届高三9月入学考试化学试题(已下线)2019年9月22日 《每日一题》 2020年高考一轮复习-每周一测山东省泰安市宁阳县第一中学2019-2020学年高二上学期第一次段考化学试题(已下线)2019年12月4日 《每日一题》人教版(选修4)——电解精炼铜福建省泉州第十六中学2019-2020学年高二10月份月考化学试题2020年春季人教版高中化学选修4第四章《电化学基础》测试卷河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题(已下线)【新东方】 2020-2福建省安溪一中2020年高一实验班线上阶段测试化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷四川省自贡市田家炳中学2019-2020学年高二下学期开学考试化学试题甘肃省西北师范大学附属中学2019-2020学年高二上学期期中考试化学试题甘肃省武威第一中学2019-2020学年高二下学期期中考试化学试题四川省泸县第四中学2019-2020学年高二下学期第四学月考试化学试题四川省泸县第一中学2019-2020学年高二下学期第四学月考试化学试题云南省昆明市官渡区第一中学2019-2020学年高二下学期期中考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题黑龙江省哈尔滨市第一中学校2021届高三上学期开学测试化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第3节 电能转化为化学能——电解 课时2 电解原理的应用鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第3节 电能转化为化学能——电解高中必刷题高二选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用山东省菏泽市单县第五中学2020-2021学年高二上学期第一次月考(10月)化学试题福建省永安市第三中学2020-2021学年高二10月月考化学(选考班)试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用湖北省武汉市蔡甸区汉阳一中2020-2021学年高二上学期9月联考化学试题(已下线)专题4.3.2 电解原理的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)4.2.2 电解原理的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)河北省石家庄市藁城区第一中学2019-2020学年高二上学期第三次月考化学试题(已下线)4.3.2 电解原理的应用(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练浙江省宁波市北仑中学2020-2021学年高一下学期期中考试化学(1班选考)试题解题达人.化学选择题(2021全国卷)提升小卷05江苏省苏州市吴中区2020-2021学年高二下学期期中调研测试化学试题河北沧州泊头一中2020-2021学年高一下学期第二次月考化学试卷黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题贵州省遵义市2020~2021学年高二下学期期末质量检测化学试题黑龙江省哈尔滨市第九中学校2020-2021学年高一下学期6月月考化学试题选择性必修1专题1第二单元 课时4 电解原理的应用(已下线)1.2.4 电解原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)江苏省外国语学校2020-2021学年高二下学期期中调研测试化学试卷河南省南阳市第五中学2021-2022学年高二上学期10月月考化学试题 福建师范大学附属中学2021-2022学年高二上学期期中考试化学试题黑龙江省实验中学2021-2022学年高二上学期期中考试化学试题(已下线)4.2.2 电解原理的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)内蒙古包头市2021-2022学年高二上学期期末考试化学试题辽宁省沈阳市市级重点高中联合体2021-2022学年高二上学期期末考试化学试题浙江省舟山市2021-2022学年高二上学期期末检测化学试题河北省保定市博野中学2021-2022学年高二上学期12月月考化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题辽宁省部分中学2021-2022学年高二下学期期末检测化学试题山东省德州市2020-2021学年高二上学期反应原理月考(B)化学试题辽宁省部分中学2021-2022学年高二上学期期末测试化学试题黑龙江省嫩江市第一中学2021-2022学年高二下学期开学考试化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期5月月考化学试题(已下线)第四章 化学反应与电能(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)湖北省襄阳市第一中学2022-2023学年高二上学期12月线上考试化学试题新疆阿克苏市实验中学2021-2022学年高二上学期期末考试化学试题(已下线)4.2.2 电解原理的应用-同步学习必备知识(已下线)第六章 化学反应与能量 第37讲 电解池 金属的腐蚀与防护第2课时 电解原理的应用福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题
21-22高三上·广东广州·期末
名校
解题方法
7 . 甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义。
(1)一种重要的工业制备甲醇的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
已知:①CO(g)+H2O(g) CO2(g)+H2(g)△H1=-40.9kJ·mol-1
CO2(g)+H2(g)△H1=-40.9kJ·mol-1
②CO(g)+2H2(g) CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1
试计算制备反应的△H=___ 。
(2)对于反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),v正=k正p(CO2)p3(H2),v逆=k逆p(CH3OH)p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。
CH3OH(g)+H2O(g),v正=k正p(CO2)p3(H2),v逆=k逆p(CH3OH)p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。
在540K下,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系图:____ (用字母表示)。
②点N在线b上,计算540K的压强平衡常数Kp=___ (用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时v正:v逆=___ 。
(3)甲醇催化可制取丙烯,反应为:3CH3OH(g) C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-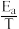 +C(Ea为活化能,k为速率常数,R和C为常数)。
+C(Ea为活化能,k为速率常数,R和C为常数)。
①该反应的活化能Ea=___ kJ·mol-1。
②当使用更高效催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图___ 。____ 。
(1)一种重要的工业制备甲醇的反应为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H已知:①CO(g)+H2O(g)
 CO2(g)+H2(g)△H1=-40.9kJ·mol-1
CO2(g)+H2(g)△H1=-40.9kJ·mol-1②CO(g)+2H2(g)
 CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1试计算制备反应的△H=
(2)对于反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),v正=k正p(CO2)p3(H2),v逆=k逆p(CH3OH)p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。
CH3OH(g)+H2O(g),v正=k正p(CO2)p3(H2),v逆=k逆p(CH3OH)p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系图:
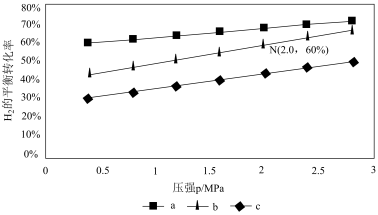
②点N在线b上,计算540K的压强平衡常数Kp=
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时v正:v逆=
(3)甲醇催化可制取丙烯,反应为:3CH3OH(g)
 C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-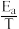 +C(Ea为活化能,k为速率常数,R和C为常数)。
+C(Ea为活化能,k为速率常数,R和C为常数)。①该反应的活化能Ea=
②当使用更高效催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图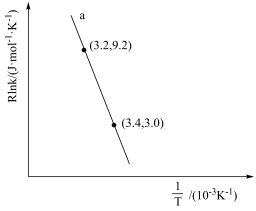
您最近一年使用:0次
2022-01-23更新
|
744次组卷
|
4卷引用:广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题
(已下线)广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题广东名校2021-2022学年高三下学期开学测试化学试题八省八校(T8联考湖北版)2021-2022学年高三下学期第二次联考化学试题 湖南省岳阳市2024届高三下学期考情信息卷化学试题
2022·四川成都·二模
8 . 锰及其化合物用途广泛,以菱锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐以及SiO2杂质)为原料生产金属锰和高品位MnCO3的工艺流程如图。

已知25℃,部分物质的溶度积常数如表:
(1)“溶浸”时,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件(温度、时间)为______ 。

(2)MnO2主要用于氧化______ 。滤渣1中残余的MnO2可加入葡萄糖一硫酸溶液处理,回收Mn2+,氧化产物为CO2。写出对应的离子方程式______ 。
(3)“除杂”步骤所得滤渣2的主要成分为MnS、______ (填化学式,其中Co、Ni均为+2价)。
(4)“沉锰”时NH4HCO3除了作沉淀剂外,还有______ 作用;“沉锰”的关键操作有两点:①将NH4HCO3溶液加入MnSO4溶液中;②反应终点pH在7附近。如果①中颠倒试剂滴加顺序(反应pH大于7),可能造成的后果是______ ;若反应终点pH低于7,可能的后果是______ 。
(5)以Fe作电极,MnSO4、ZnSO4溶液为电解液,经过一系列步骤制得隐形战机涂料Zn2Mn(1-x)Fe2O4,则电解时阳极生成Zn2Mn(1-x)Fe2O4的总反应为_______ 。

已知25℃,部分物质的溶度积常数如表:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 |

(2)MnO2主要用于氧化
(3)“除杂”步骤所得滤渣2的主要成分为MnS、
(4)“沉锰”时NH4HCO3除了作沉淀剂外,还有
(5)以Fe作电极,MnSO4、ZnSO4溶液为电解液,经过一系列步骤制得隐形战机涂料Zn2Mn(1-x)Fe2O4,则电解时阳极生成Zn2Mn(1-x)Fe2O4的总反应为
您最近一年使用:0次
2022-03-23更新
|
893次组卷
|
3卷引用:必刷卷01-2022年高考化学考前信息必刷卷(广东专用)
名校
解题方法
9 . 上饶市正在创建“全国文明城市”,对碳的化合物做广泛深入的研究并妥善处理具有重要意义。
I.CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:

(1)容易得到的副产物有CO和CH2O,其中相对较少的副产物为______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中______ (填字母)的能量变化。
A.•OCH3 •CH3OH B.•CO
•CH3OH B.•CO •OCH
•OCH
C. •OCH2 •OCH3 D.•CO + •OH
•OCH3 D.•CO + •OH •CO + •H2O
•CO + •H2O
II.天然气一个重要的用途是制取H2,其原理为CO2(g)+ CH4(g)⇌2CO(g)+2H2(g)。
(2)在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(CO)正______ v(H2)逆(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。若平衡时气体的总压强为3×106Pa,求x点对应温度下反应的平衡常数Kp=______ Pa2。
(3)天然气中少量的杂质通常用氨水吸收,产物为硫氢化铵。一定条件下向硫氢化铵溶液中通入空气,得到单质硫并使吸收液再生。写出再生反应的化学方程式:______ 。
III.利用铜基配合1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。

(4)电池工作过程中,阴极的电极反应式为______ 。
(5)每转移0.2mol电子,阳极室溶液质量减少______ g。
I.CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:

(1)容易得到的副产物有CO和CH2O,其中相对较少的副产物为
A.•OCH3
 •CH3OH B.•CO
•CH3OH B.•CO •OCH
•OCHC. •OCH2
 •OCH3 D.•CO + •OH
•OCH3 D.•CO + •OH •CO + •H2O
•CO + •H2OII.天然气一个重要的用途是制取H2,其原理为CO2(g)+ CH4(g)⇌2CO(g)+2H2(g)。
(2)在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(CO)正
(3)天然气中少量的杂质通常用氨水吸收,产物为硫氢化铵。一定条件下向硫氢化铵溶液中通入空气,得到单质硫并使吸收液再生。写出再生反应的化学方程式:
III.利用铜基配合1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。

(4)电池工作过程中,阴极的电极反应式为
(5)每转移0.2mol电子,阳极室溶液质量减少
您最近一年使用:0次
2021-04-04更新
|
169次组卷
|
2卷引用:广东省深圳市龙华中学2021-2022学年高三下学期(二月第一次)半周测化学试题
名校
解题方法
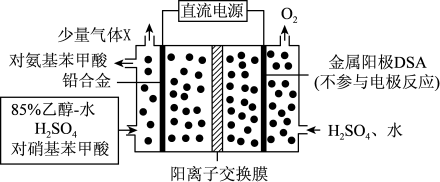
10 . 对氨基苯甲酸(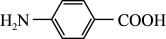 )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸( )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
 )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸( )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
| A.电流由金属阳极DSA经导线流入直流电源 |
B.阴极的主要电极反应式为: +6e- +6H+→ +6e- +6H+→ +2H2O +2H2O |
| C.每转移1mole-时,阳极电解质溶液的质量减少8g |
| D.反应结束后阳极区pH增大 |
您最近一年使用:0次



