1 . 已知下列电子排布图所表示的是元素的原子,其中能量处于最低状态的是
A.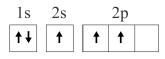 | B.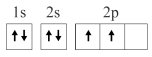 |
C.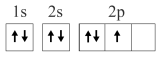 | D. |
您最近一年使用:0次
2021-05-28更新
|
1609次组卷
|
30卷引用:云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题
云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题云南省广南县第三中学校2019-2020学年高二上学期期末考试化学试题云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题(已下线)2014届四川省富顺一中高二上学期第一次月考化学试卷2015-2016学年湖北省黄冈市高二下期末化学试卷2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2人教版2017-2018学年高二化学选修三同步训练:1.1 原子结构(第2课时)广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题2020届高三化学二轮物质结构题型专攻—— 基态原子核外电子排布【选择基础专练】人教化学选修3第一章第一节课时3河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题吉林省长春市第一中学2019-2020学年高二下学期阶段测试化学试题河南省洛阳市2019-2020学年高二下学期期末质量检测化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第一次月考化学试题甘肃省静宁县第一中学2020-2021学年高二上学期期末考试化学(实验班)试题吉林省通化县综合高级中学2019-2020学年高二下学期期末考试化学试题河北省石家庄市第十五中学2020-2021学年高二第二学期4月月考化学试题(已下线)作业01 原子结构-2021年高二化学暑假作业(人教版2019)(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.1 原子结构(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1.1.3讲 泡利原理、洪特规则、能量最低原理 -2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)河南省新乡市河南师范大学附属中学2021-2022学年高二下学期3月月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期期中考试化学试题内蒙古通辽市开鲁县第一中学2021-2022学年高二下学期期中考试化学试题甘肃省高台县第一中学2021-2022学年高二下学期6月月考化学试题专题2 原子结构与元素性质 本专题复习提升四川省自贡市富顺县城关中学2021-2022学年高一下学期期中考试化学试题1.1.3 泡利原理、洪特规则、能量最低原理-随堂练习
名校
2 . 下列说法正确的是
A.CH4分子的球棍模型为 |
B.铍原子最外层的电子云图为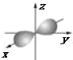 |
C.基态Fe原子的价电子轨道表示式为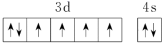 |
D.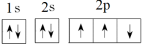 ,该轨道表示式违背了泡利不相容原理 ,该轨道表示式违背了泡利不相容原理 |
您最近一年使用:0次
2021-01-29更新
|
1648次组卷
|
11卷引用:云南省昆明市官渡区尚品书院学校2022-2023学年高二下学期3月月考化学试题
云南省昆明市官渡区尚品书院学校2022-2023学年高二下学期3月月考化学试题山东省烟台市2020-2021学年高二上学期期末考试化学试题(已下线)专题一 原子结构-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题一 原子结构-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)湖北省枣阳市第一中学2020-2021学年高二下学期3月月考化学试题广东省茂名市“五校联盟” 2021-2022学年高二上学期期末联考化学试题山东省烟台市莱州第一中学2021-2022学年高二12月月考化学试题福建省福州市四校联盟2021-2022学年高二下学期期中联考化学试题第一章原子结构与性质(提升卷)新疆乌鲁木齐市第三十一中学2021-2022学年高二下学期期中考试化学试题福建省漳州市东山第二中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
3 . 钇(Y)是一种用途广泛的金属,是稀土元素之一,钇钡铜氧化物是一种高温超导材料。回答下列问题:
(1)钇的原子序数为39,其基态原子的外围电子排布式为________ ;钡、铜的焰色对应的辐射波长Ba____ Cu(填“大于”或“小于”)。
(2)(C4H9O)3PO(磷酸三丁酯)是一种提炼稀土常用的萃取剂,其四种组成元素中,电负性最大的是______ ;(C4H9O)3PO中P原子的轨道杂化类型为______ 。
(3)Y和Cu都可形成配合物。向CuSO4溶液中滴加氨水,先生成蓝色沉淀,后蓝色沉淀溶解得到[Cu(NH3)4]SO4深蓝色透明溶液。若[Cu(NH3)4]2+中的两个NH3被两个NH2R替换,得到两种不同构型的产物,则[Cu(NH3)4]2+的空间构型为_____ ,其判断理由是_______ ;若向[Cu(NH3)4]SO4溶液中加入乙醇,将析出深蓝色晶体,[Cu(NH3)4]SO4难溶于乙醇的原因可能是____________ .
(4)某种由Y、Ba、Cu、O构成的超导化合物的晶胞结构如图所示。
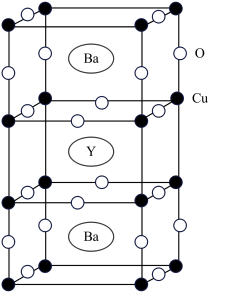
①该化合物中,Y、Ba的化合价分别为+3、+2,Cu的平均化合价为_________ 。
②已知:晶胞参数为a=381.7 pm、b=388.3 pm、c=1163.3 pm,α=β=γ=90°,设NA为阿伏加德罗常数的值,则该晶体的密度为______ g.cm-3(列出计算式即可)。
(1)钇的原子序数为39,其基态原子的外围电子排布式为
(2)(C4H9O)3PO(磷酸三丁酯)是一种提炼稀土常用的萃取剂,其四种组成元素中,电负性最大的是
(3)Y和Cu都可形成配合物。向CuSO4溶液中滴加氨水,先生成蓝色沉淀,后蓝色沉淀溶解得到[Cu(NH3)4]SO4深蓝色透明溶液。若[Cu(NH3)4]2+中的两个NH3被两个NH2R替换,得到两种不同构型的产物,则[Cu(NH3)4]2+的空间构型为
(4)某种由Y、Ba、Cu、O构成的超导化合物的晶胞结构如图所示。

①该化合物中,Y、Ba的化合价分别为+3、+2,Cu的平均化合价为
②已知:晶胞参数为a=381.7 pm、b=388.3 pm、c=1163.3 pm,α=β=γ=90°,设NA为阿伏加德罗常数的值,则该晶体的密度为
您最近一年使用:0次
2022-03-10更新
|
531次组卷
|
4卷引用:云南省昆明一中、宁夏银川一中2021-2022学年高三下学期联合考试一模理科综合化学试题
云南省昆明一中、宁夏银川一中2021-2022学年高三下学期联合考试一模理科综合化学试题(已下线)二轮拔高卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)黑龙江省齐齐哈尔市第一中学校2022届高三下学期二模理科综合化学试题吉林市第一中学2021-2022学年高三下学期4月教学质量检测理科综合化学试题
真题
名校
4 . 硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为_______ ,该能层具有的原子轨道数为________ 、电子数为___________ 。
(2)硅主要以硅酸盐、___________ 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以___________ 相结合,其晶胞中共有8个原子,其中在面心位置贡献__________ 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为___________________________________ 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______ 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是___________________________ 。
(6)在硅酸盐中,SiO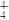 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______ ,Si与O的原子数之比为_________ ,化学式为__________________ 。
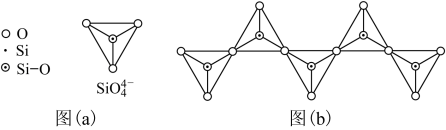
(1)基态Si原子中,电子占据的最高能层符号为
(2)硅主要以硅酸盐、
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
(6)在硅酸盐中,SiO
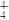 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
您最近一年使用:0次
2019-01-30更新
|
3768次组卷
|
9卷引用:2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷
5 . 下列各能层中不包含p能级的是
| A.K | B.L | C.M | D.N |
您最近一年使用:0次
2021-05-28更新
|
1475次组卷
|
35卷引用:云南省景东一中2017-2018学年高二下学期6月份考试化学试题
云南省景东一中2017-2018学年高二下学期6月份考试化学试题2014-2015学年湖北省长阳县第一高级中学高二上学期期中化学试卷贵州省遵义市习水县一中2018-2019学年高二上学期11月考试化学试题贵州省习水县一中2018-2019学年高二上学期12月份月考化学试题甘肃省武威市第十八中学 2017-2018学年高二下学期期中考试化学试题吉林省汪清县第六中学2018-2019学年高二6月月考化学试题新疆喀什巴楚县第一中学2019-2020学年高二下学期期中考试化学(B卷)试题新疆喀什巴楚县第一中学2019-2020学年高二下学期期中考试化学(A卷)试题新疆吐蕃市高昌区第二中学2019-2020学年高二下学期期末考试化学试题新疆维吾尔自治区喀什巴楚县第一中学2020-2021学年高二上学期第一次月考化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题(已下线)模块同步卷01 原子结构和元素周期律-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)河北省石家庄卓越联盟2020-2021学年高二3月月考化学试题(已下线)作业01 原子结构-2021年高二化学暑假作业(人教版2019)人教2019选择性必修2第一章第一节 原子结构课后习题四川省乐山市2021-2022学年高二上学期期末教学质量检测化学试题(已下线)第1.1.1讲 能层与能级 基态与激发态-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)广东省惠州市博罗县2021-2022学年高二下学期期中考试化学试题福建省南安市侨光中学、昌财实验中学2021-2022学年高二下学期第4次联考(期中)化学试题新疆额敏县第二中学2021-2022学年高二下学期期中考试化学试题广东省汕头市潮南区陈店实验学校2021-2022学年高二下学期第一次月考化学试题陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考化学试题吉林省普通高中友好学校联合体2022-2023学年高二下学期期中联考化学试题安徽省安庆市宿松中学、程集中学等高中2022-2023学年高二下学期期中联考化学试题福建省德化第二中学2022-2023学年高二下学期期中考试化学试题新疆喀什地区巴楚县第一中学2023-2024学年高二上学期1月期末化学试题(已下线)热点01 原子结构新疆博湖县奇石中学2022-2023学年高二下学期期末考试化学试题广东省广州市广雅中学2023-2024学年高二下学期学科综合素养评估化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题福建省厦门第一中学2023-2024学年高二下学期第一次月考化学试题黑龙江省黑河市第一中学2023-2024学年高二下学期4月月考化学试题四川省南充市阆中中学校2023-2024学年高二下学期3月月考化学试卷天津市第九十五中学益中学校2023-2024学年高二下学期第一次月考化学试卷
名校
解题方法
6 . 表格为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
(1)在以上元素的基态原子的电子排布中4s轨道只有1个电子的元素有____ (填元素名称)。
(2)写出Cr3+的电子排布式____ 。
(3)Fe3+的化学性质比Fe2+稳定,其原因是____ 。
(4)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有____ 种。
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)在以上元素的基态原子的电子排布中4s轨道只有1个电子的元素有
(2)写出Cr3+的电子排布式
(3)Fe3+的化学性质比Fe2+稳定,其原因是
(4)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有
您最近一年使用:0次
7 . 具有下列电子层结构的原子,其第一电离能由大到小排列正确的是
①3p轨道上只有一对成对电子的原子;
②外围电子构型为3s23p6的原子;
③其3p轨道为半满的原子;
④正三价的阳离子结构与氖相同的原子
①3p轨道上只有一对成对电子的原子;
②外围电子构型为3s23p6的原子;
③其3p轨道为半满的原子;
④正三价的阳离子结构与氖相同的原子
| A.①②③④ | B.③①②④ | C.②③①④ | D.②④①③ |
您最近一年使用:0次
2021-02-22更新
|
1554次组卷
|
20卷引用:云南省永胜县第一中学2020-2021学年高二下学期6月份考试化学试题
云南省永胜县第一中学2020-2021学年高二下学期6月份考试化学试题(已下线)2012届安徽省望江县高三上学期第二次月考化学试卷(已下线)2013届辽宁省鞍山一中上学期期中考试高二年级化学试卷 (已下线)2013届山西省山西大学附中高三9月月考化学试卷2015-2016学年山西省太原五中高二下4月月考化学试卷2015-2016学年广东汕头金山中学高二下第十周练化学卷(已下线)2018年11月23日 《每日一题》人教版一轮复习-电离能和电负性山东省泰安市2019-2020学年高二上学期期末考试化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质湖北省石首市第一中学2019-2020学年高二下学期摸底考试化学试题(已下线)1.3.1 电离能及其变化规律-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)四川省成都市阳安中学2020-2021学年高二下学期3月月考化学试题内蒙古集宁新世纪中学2020-2021学年高二下学期期末考试化学试题山西省太原市第五中学2021-2022学年高二下学期4月阶段性检测化学试题第一章 本章复习提升1山西省太原市英才学校2021-2022学年高二下学期线上期中化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第1章01讲核心安徽省合肥市第六中学2022-2023学年高二下学期3月段考化学试题第一章 原子结构与性质(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
名校
解题方法
8 . 磷酸铁锂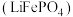 电极材料主要用于各种锂离子电池,回到下列问题
电极材料主要用于各种锂离子电池,回到下列问题
(1) 位于元素周期表中第
位于元素周期表中第_______ 周期_______ 族,其价电子排布式为_______ 。
(2)用“>”、“<”成“=”填空:离子半径:
_______  ;第一电离能:
;第一电离能:
_______  ;电负性:O
;电负性:O_______ P。
(3)在周期表中,化学性质最相似的邻族元素是_______ 。
(4)下列 原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
(5)基态P中未成对的电子数为_______ ,其原子核外电子占据的最高能级的电子云轮廓为_______ 形。
(6) 与
与 两元素的部分电离能数据如下,由表中两元素的
两元素的部分电离能数据如下,由表中两元素的 和
和 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难,对此,你的解释是
再失去一个电子更难,对此,你的解释是_______ 。
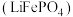 电极材料主要用于各种锂离子电池,回到下列问题
电极材料主要用于各种锂离子电池,回到下列问题(1)
 位于元素周期表中第
位于元素周期表中第(2)用“>”、“<”成“=”填空:离子半径:

 ;第一电离能:
;第一电离能:
 ;电负性:O
;电负性:O(3)在周期表中,化学性质最相似的邻族元素是
(4)下列
 原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。A. | B.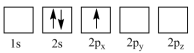 |
C. | D. |
(6)
 与
与 两元素的部分电离能数据如下,由表中两元素的
两元素的部分电离能数据如下,由表中两元素的 和
和 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难,对此,你的解释是
再失去一个电子更难,对此,你的解释是| 元素 |  |  | |
电离能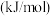 |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 |
您最近一年使用:0次
2022-01-22更新
|
581次组卷
|
3卷引用:云南省部分重点中学2022-2023学年高三上学期月考化学试题
9 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态 Y 原子有3个未成对电子,基态Z原子的价电子数等于其电子层数,这四种元素可形成离子化合物| 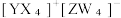 下列叙述正确的是
下列叙述正确的是
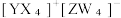 下列叙述正确的是
下列叙述正确的是| A.氧化性:Y2>W2 | B.电负性:Y>X>Z |
| C.YW3的空间结构为平面三角形 | D.第一电离能:Y<W |
您最近一年使用:0次
2023-10-17更新
|
479次组卷
|
4卷引用:云南省部分名校2023-2024学年高三上学期10月联考理科综合化学试题
名校
10 . 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
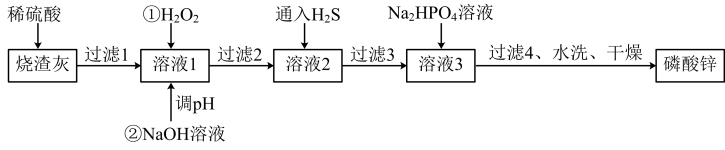
已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
(1)基态Zn原子的价电子排布式为______
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是______ (填一条)。
(3)加入H2O2的作用_______
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是______ 。
(5)加入Na2HPO4溶液发生反应的离子方程式为_____ 。
(6)洗涤磷酸锌沉淀时应选用____ (填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是_____ 。
(7)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=______ (已知:25°C时,H2S的电离平衡常数Ka1=1×10-7,Ka2=1×10-15)。

已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是
(3)加入H2O2的作用
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(5)加入Na2HPO4溶液发生反应的离子方程式为
(6)洗涤磷酸锌沉淀时应选用
(7)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=
您最近一年使用:0次
2022-08-25更新
|
490次组卷
|
3卷引用:云南师范大学附属中学2022-2023学年高三上学期高考适应性月考卷(二)理科综合化学试题



