解题方法
1 . 2020年9月,中国向联合国大会宣布“30.60目标”,即二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。目前我国正在大力发展新能源车。磷酸铁锂电池主要成分为LiFePO4,可采用二价铁盐或三价铁盐、H3PO4、NH3∙H2O等作为原料制备。
(1)H3PO4中PO 空间构型为
空间构型为___________
(2)Fe2+的电子排布式为___________ 。Fe3+比Fe2+更稳定的原因是___________ 。
(3)NH3和PH3结构相似,但NH3易溶于水,PH3难溶于水,原因是___________
(4)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
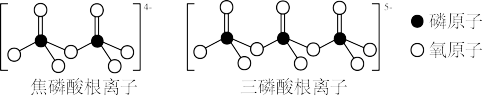
这类磷酸根离子的化学式可用通式表示为___________ (用n代表P原子数)。
(5)石墨可用作锂离子电池的负极材料,Li+嵌入石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如图甲所示,则x=___________ ;若每个六元环都对应一个Li+,则化学式为___________ 。
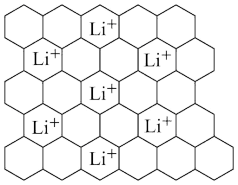
甲
(6)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中的位置如图乙所示,其堆积方式为___________ ,Li+占据阴离子组成的所有正四面体空隙中心,该化合物的化学式为___________ (用最简整数比表示)。假设晶胞边长为a nm,则该晶胞的密度为___________ g/cm-3(用含a、NA的代数式表示)。
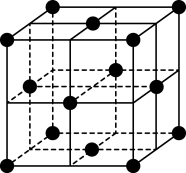
乙
(1)H3PO4中PO
 空间构型为
空间构型为(2)Fe2+的电子排布式为
(3)NH3和PH3结构相似,但NH3易溶于水,PH3难溶于水,原因是
(4)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:

这类磷酸根离子的化学式可用通式表示为
(5)石墨可用作锂离子电池的负极材料,Li+嵌入石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如图甲所示,则x=

甲
(6)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中的位置如图乙所示,其堆积方式为

乙
您最近一年使用:0次
2 . 按照下列元素基态原子的电子排布特征回答问题。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为3s23p6;F为金属元素且原子核外p电子数和s电子数相等。
(1)B元素在元素周期表中的位置:___________ 。
(2)上述元素中位于s区的有___________ (填元素符号)。
(3)写出C元素基态原子价电子排布图:___________ 。
(4)检验某溶液中是否含有D+,可通过___________ 反应来实现;检验某溶液中是否含有B-,通常所用的试剂是___________ 和___________ 。
(5)写出E的元素符号:___________ ,要证明太阳上是否含有E元素,可采用的方法是___________ 。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素的原子最外层电子排布式为3s23p6;F为金属元素且原子核外p电子数和s电子数相等。
(1)B元素在元素周期表中的位置:
(2)上述元素中位于s区的有
(3)写出C元素基态原子价电子排布图:
(4)检验某溶液中是否含有D+,可通过
(5)写出E的元素符号:
您最近一年使用:0次
2021-06-02更新
|
733次组卷
|
5卷引用:云南省新平县一中2020-2021学年高二下学期期中考试化学试题
云南省新平县一中2020-2021学年高二下学期期中考试化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)广东省江门市第二中学2021-2022学年高二上学期期中考试化学试题(已下线)BBWYhjhx1112.pdf
3 . 下列关于元素第一电离能的说法不正确的是
| A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 |
| B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 |
| C.最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大 |
| D.对于同一元素而言,原子的电离能I1<I2<I3…… |
您最近一年使用:0次
2021-06-05更新
|
1029次组卷
|
54卷引用:云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题
云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题云南省丽江市永胜县第二中学2019—2020学年高二上学期期末考试化学试题云南省玉溪市华宁二中2020-2021学年高二下学期期中考试化学试题(已下线)2009—2010泉州七中学年度下学期高二年期中考试化学卷(已下线)2012-2013学年陕西省宝鸡中学高二下学期期中考试化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年河北邢台一中高二上学期期中测试化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2016-2017学年湖北省武汉市第二中学高二下学期期中考试化学试卷湖北省武汉市第二中学2016-2017学年高二下学期期中考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题四川省广安市2017-2018学年高二上学期期末考试化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第2课时【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题山西省临猗县临晋中学2017-2018学年高二下学期期末考试化学试题贵州省织金县第一中学2018-2019学年高二上学期期中考试化学试题四川省宜宾市第四中学2018-2019学年高二上学期期末模拟理科综合化学试题【全国百强校】山东省潍坊第一中学2018-2019学年高二下学期开学(2月)考试化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二下学期4月月考化学试题吉林省乾安县第七中学2018-2019学年高二下学期第二次质量检测化学试题(已下线)专题11.3 晶体结构与性质(练)-《2020年高考一轮复习讲练测》人教化学选修3第一章第二节课时6第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)海南省海口市海南枫叶国际学校2019-2020学年高二下学期期中考试化学试题(已下线)第十一单元 物质的结构与性质测试题-2021年高考化学一轮复习名师精讲练(已下线)山东省邹城市2018-2019学年高二上学期12月月考化学试卷宁夏回族自治区银川市宁夏大学附属中学2020-2021学年高二上学期第一次月考化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 易错颖难集训(二)高二选择性必修2(人教版2019)第一章 原子结构与性质 第二节综合训练鲁科版2019选择性必修2第1章 原子结构与元素性质 第1章学科素养提升(人教版2019)选择性必修2第一章 原子结构与性质 学科素养提升(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)(已下线)1.3.1 电离能及其变化规律-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记山西省太原市第五十六中学校2020-2021学年高二第一次月考化学试题宁夏银川市贺兰县景博高中2020-2021学年高二下学期期中考试化学试题黑龙江省齐齐哈尔市第八中学校2020-2021学年高二下学期期中考试化学试题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)(已下线)1.2.2 原子结构与元素周期律(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)1.2.2 原子半径 元素的电离能及其变化规律-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)陕西省咸阳市实验中学2021-2022学年高二上学期第一次月考化学试题(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化第一章 本章达标检测2江苏省盐城市东台创新高级中学2021-2022学年高二2月份月检测化学试题广东省茂名市电白区2022-2023学年高二上学期期末考试化学(选择性考试)试题安徽省 淮北师范大学附属实验中学2022-2023学年高二下学期第一次月考化学试题2.2.2元素第一电离能和电负性的周期性变化 课中陕西省宝鸡市渭滨区2023-2024学年高二上学期期末考试化学试题山东省青岛一中2023-2024学年高一下学期4月月考化学试卷
名校
4 . 首例有机小分子催化剂催化的不对称Aldol反应如下:
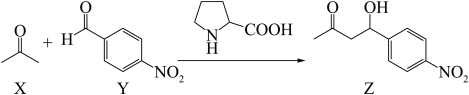
下列说法错误的是

下列说法错误的是
| A.X分子中σ键和π键数目之比为3: 1 |
| B.Y分子中所有原子可能在同一平面内 |
| C.Z能发生氧化、取代、消去反应 |
| D.第一电离能:N>O>C |
您最近一年使用:0次
2023-04-24更新
|
403次组卷
|
2卷引用:云南省昆明市云南民族大学附属高级中学2023-2024学年高三上学期第一次月考理综化学试题
名校
解题方法
5 . 镍及其化合物在工业生产中具有重要作用,回答下列问题:
(1)层状镍钴锰三元材料可用作锂离子电池正极材料,化学式可表示为LiNixCoyMnzO2,其五种组成元素中第一电离能最小的是___________ ;基态Ni2+与Co2+离子中未成对电子数之比为___________ 。
(2)镍的配合物[Ni(CN)4]SO4中,配位数为___________ ,配体的空间构型为___________ ,S原子的杂化轨道类型为___________ 。
(3)镍的另一种配合物Ni(CO)4的熔点、沸点分别为-25℃、43℃,其晶体中存在的作用力有___________ (填标号);
A.离子键B.极性键C.非极性键D.配位键E.范德华力
Ni(CO)4___________ (填“能”或“不能")溶于水,其判断理由是___________ 。
(4)某镧镍合金的结构属六方晶系(晶胞参数为apm、apm、cpm,α=β=90°,γ=120°),是一种储氢材料,储氢后的晶胞结构如图。若储氢前后晶胞参数不变,则储氢后晶体的密度为___________ g·cm-3(设阿伏加德罗常数的值为NA)。
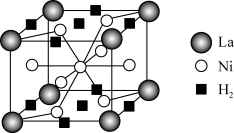
(1)层状镍钴锰三元材料可用作锂离子电池正极材料,化学式可表示为LiNixCoyMnzO2,其五种组成元素中第一电离能最小的是
(2)镍的配合物[Ni(CN)4]SO4中,配位数为
(3)镍的另一种配合物Ni(CO)4的熔点、沸点分别为-25℃、43℃,其晶体中存在的作用力有
A.离子键B.极性键C.非极性键D.配位键E.范德华力
Ni(CO)4
(4)某镧镍合金的结构属六方晶系(晶胞参数为apm、apm、cpm,α=β=90°,γ=120°),是一种储氢材料,储氢后的晶胞结构如图。若储氢前后晶胞参数不变,则储氢后晶体的密度为

您最近一年使用:0次
2022-03-03更新
|
380次组卷
|
2卷引用:云南省昆明市第一中学2022届高三第七次高考仿真模拟理科综合化学试题
6 . 无水二氯化锰(MnCl2,极易吸水潮解,易溶于水、乙醇和醋酸,不溶于苯)常用于铝合金冶炼、有机氯化物触媒等,某兴趣小组用四水醋酸锰[(CH3COO)2Mn·4H2O]和乙酰氯(CH3COCl,沸点:51℃,与水反应生成CH3COOH和HCl为原料制备无水二氯化锰。实验步骤如下:
Ⅰ.将四水醋酸锰、乙酰氯和苯加入容器中,室温搅拌、静置一会,抽滤,得到无水醋酸锰;
Ⅱ.将无水醋酸锰、苯加入烧瓶中,滴加乙酰氯,加热回流,反应完全后,静置,抽滤、洗涤,得到无水二氯化锰粗产品。装置(夹持装置已省略)如图1所示;
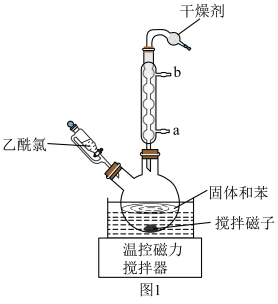
Ⅲ.将无水二氯化锰粗产品进行纯化,得到无水二氯化锰。
回答下列问题:
(1)基态Mn2+核外电子排布式为___________ ;图1中,盛放乙酰氯的仪器名称为___________ 。
(2)简述步骤Ⅰ能获得无水醋酸锰的原理:___________ (语言叙述)。
(3)步骤Ⅱ除了生成无水二氯化锰外,还有(CH3CO)2O生成,写出该反应的化学方程式:___________ 。
(4)步骤Ⅰ设置室温下反应,而步骤Ⅱ设置在加热回流下反应,其原因是___________ 。
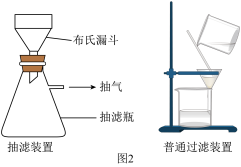
(5)抽滤和普通过滤装置如图2所示,简述抽滤的优点:___________ (任写一种)。
(6)步骤Ⅲ纯化时,装置如图3所示:
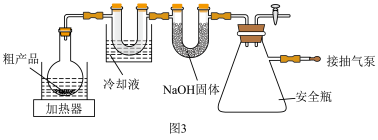
①打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化。请给纯化完成后的操作排序:纯化完成→(___________ )→(___________ )→(___________)→(___________ ) →将产品转至干燥器中保存,_______
a.拔出圆底烧瓶的瓶塞
b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温
d.打开安全瓶上旋塞
②图3装置中U形管内NaOH固体的作用是___________ (写一条即可)。
(7)用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通。过测定产品中氯元素的含量确定纯度。合理的是___________ (填“甲”或“乙”)同学的方法。
Ⅰ.将四水醋酸锰、乙酰氯和苯加入容器中,室温搅拌、静置一会,抽滤,得到无水醋酸锰;
Ⅱ.将无水醋酸锰、苯加入烧瓶中,滴加乙酰氯,加热回流,反应完全后,静置,抽滤、洗涤,得到无水二氯化锰粗产品。装置(夹持装置已省略)如图1所示;

Ⅲ.将无水二氯化锰粗产品进行纯化,得到无水二氯化锰。
回答下列问题:
(1)基态Mn2+核外电子排布式为
(2)简述步骤Ⅰ能获得无水醋酸锰的原理:
(3)步骤Ⅱ除了生成无水二氯化锰外,还有(CH3CO)2O生成,写出该反应的化学方程式:
(4)步骤Ⅰ设置室温下反应,而步骤Ⅱ设置在加热回流下反应,其原因是
(5)抽滤和普通过滤装置如图2所示,简述抽滤的优点:

(6)步骤Ⅲ纯化时,装置如图3所示:

①打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化。请给纯化完成后的操作排序:纯化完成→(___________ )→(___________ )→(___________)→(___________ ) →将产品转至干燥器中保存,
a.拔出圆底烧瓶的瓶塞
b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温
d.打开安全瓶上旋塞
②图3装置中U形管内NaOH固体的作用是
(7)用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通。过测定产品中氯元素的含量确定纯度。合理的是
您最近一年使用:0次
2023-04-24更新
|
420次组卷
|
2卷引用:云南省昆明市云南民族大学附属高级中学2023-2024学年高三上学期第一次月考理综化学试题
9-10高二下·福建三明·期中
名校
解题方法
7 . 下列各组表述中,两个微粒一定不属于同种元素原子的是( )
| A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子 |
| B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子 |
C.最外层电子数是核外电子总数的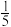 的原子和价电子排布为4s24p5的原子 的原子和价电子排布为4s24p5的原子 |
| D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子 |
您最近一年使用:0次
2020-02-15更新
|
1199次组卷
|
37卷引用:云南省澄江二中2018-2019学年高二上学期期中考试化学试题
云南省澄江二中2018-2019学年高二上学期期中考试化学试题(已下线)09~10学年三明市五校高二下学期期中联考化学卷(已下线)2011-2012学年河北省衡水中学高二下学期调考试化学试卷(已下线)2011-2012学年福建省师大附中高二下学期期末模块测试化学试卷(已下线)2012-2013学年湖北省黄冈中学高二上学期期中考试化学试卷2014-2015学年辽宁实验分校高二下6月阶段测试化学试卷2015-2016学年四川成都七中高二上12月月考化学试卷2015-2016学年安徽省六安一中高二上第二次阶段测化学卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年河北省定州中学高二下期中化学试卷2015-2016学年山西省怀仁一中高二下第三次月考化学试卷安徽省六安市第一中学2016-2017学年高二上学期期末考试化学试题2016-2017学年河南省郑州外国语学校高二下学期月考(一)化学试卷高中化学人教版 选修三 第1章 原子结构与性质 电子云与原子轨道河南省安阳市林虑中学2017-2018学年高二4月份调研考试化学试题山西省实验中学2018-2019学年高二上学期12月月考化学试题山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题安徽省蚌埠二中2019-2020学年高二下学期开学检测化学试题福建省莆田第一中学2019-2020学年高二下学期期中考试化学试题安徽省亳州市涡阳县第九中学2019-2020学年高二7月月考化学试题吉林省长春市实验中学2019-2020高二下学期期中考试化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第2节 原子结构与元素周期表(已下线)1.2.1 基态原子的核外电子排布-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练湖北武汉市蔡甸区汉阳一中2020-2021学年高二下学期3月月考化学试题福建省福清西山学校高中部2020-2021学年高二下学期期中考试化学试题湖北省黄石市有色第一中学2020-2021学年高二下学期期中考试化学试题(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.1 原子结构(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)福建省福州教育学院附属中学2021-2022学年高二下学期3月月考化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)专题强化练1 基态原子核外电子排布福建省三明第一中学2022-2023学年高二下学期第一次月考化学试题(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
8 . 短周期元素X、Y、Z、W、R的原子序数依次增大,Y与W同主族,Z与R同主族,它们形成的甲、乙两种物质(如图)是有机合成中常用的还原剂。下列说法正确的是
甲: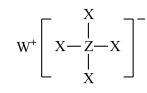 ,乙:
,乙: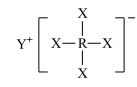
甲:
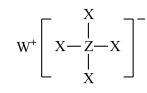 ,乙:
,乙: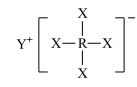
| A.电负性:X>Z>R |
| B.第一电离能:Y<Z<R |
| C.元素Z和R最高价氧化物对应的水化物都具有两性 |
| D.单质Y和W在空气中燃烧的产物所含化学键类型完全相同 |
您最近一年使用:0次
2022-03-03更新
|
723次组卷
|
6卷引用:云南省富源县第一中学2021-2022学年高三下学期4月月考化学试题
云南省富源县第一中学2021-2022学年高三下学期4月月考化学试题山东省淄博市2022届高三下学期第一次模拟考试化学试题广东省佛山市第四中学2021-2022学年高二下学期3月段考化学试题(已下线)专项08 物质结构 元素周期律-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)福建省福安市第一中学2023届高三上学期第一次检测化学试题福建省福清虞阳中学2023-2024学年高三上学期第一次综合训练化学试题
9 . 下列电子层中,含有3个能级的是
| A.K电子层 | B.L电子层 | C.M电子层 | D.N电子层 |
您最近一年使用:0次
名校
解题方法
10 . 卡塔尔世界杯是2022年全球范围内的体育盛事。世界杯中有不少化学材料的应用,如卡塔尔世界杯比赛用球“Al Rihla”外皮由20块无缝的热黏合聚氨酯板制成。在场馆建筑领域更是离不开中国设计与中国钢材料,如卡塔尔世界杯卢塞尔体育场的“钢筋铁骨”。
(1)聚氨酯,又称聚氨基甲酸酯,简称“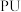 ”,是指主链中含有氨基甲酸酯特征单元(
”,是指主链中含有氨基甲酸酯特征单元(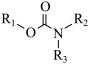 )的一类高分子化合物。基态O原子的价层电子轨道表示式为
)的一类高分子化合物。基态O原子的价层电子轨道表示式为_______ ,基态N原子核外电子的空间运动状态有_______ 种。
(2)氨基甲酸甲酯(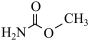 )可由氯代甲酸甲酯(
)可由氯代甲酸甲酯( )与氨制得,氨基甲酸甲酯易溶于水。
)与氨制得,氨基甲酸甲酯易溶于水。
①氨基甲酸甲酯中碳原子的杂化类型为_______ 。
②解释氨基甲酸甲酯易溶于水的主要原因:_______ 。
(3)为提高中国钢材料的性能,往往会在钢材料中添加锰和钴元素。 与
与 元素均能形成八面体的五氨基配合物
元素均能形成八面体的五氨基配合物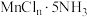 和
和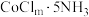 。已知
。已知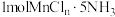 和
和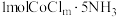 分别与足量
分别与足量 溶液反应生成
溶液反应生成 和
和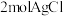 。则配合物中
。则配合物中
_______ ,
_______ 。
(4)铁有 三种典型的立方体晶胞,其中
三种典型的立方体晶胞,其中 型的立方晶胞如图所示。
型的立方晶胞如图所示。
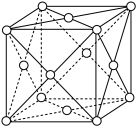
①该晶胞中含有的 原子数为
原子数为_______ 。
②若该晶胞边长为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为_______  。
。
(1)聚氨酯,又称聚氨基甲酸酯,简称“
 ”,是指主链中含有氨基甲酸酯特征单元(
”,是指主链中含有氨基甲酸酯特征单元( )的一类高分子化合物。基态O原子的价层电子轨道表示式为
)的一类高分子化合物。基态O原子的价层电子轨道表示式为(2)氨基甲酸甲酯(
 )可由氯代甲酸甲酯(
)可由氯代甲酸甲酯( )与氨制得,氨基甲酸甲酯易溶于水。
)与氨制得,氨基甲酸甲酯易溶于水。①氨基甲酸甲酯中碳原子的杂化类型为
②解释氨基甲酸甲酯易溶于水的主要原因:
(3)为提高中国钢材料的性能,往往会在钢材料中添加锰和钴元素。
 与
与 元素均能形成八面体的五氨基配合物
元素均能形成八面体的五氨基配合物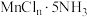 和
和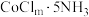 。已知
。已知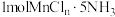 和
和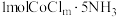 分别与足量
分别与足量 溶液反应生成
溶液反应生成 和
和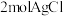 。则配合物中
。则配合物中

(4)铁有
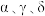 三种典型的立方体晶胞,其中
三种典型的立方体晶胞,其中 型的立方晶胞如图所示。
型的立方晶胞如图所示。
①该晶胞中含有的
 原子数为
原子数为②若该晶胞边长为
 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
2023-03-18更新
|
315次组卷
|
4卷引用:云南省昆明师范专科学校附属中学2022-2023学年高二下学期4月月考化学试题
云南省昆明师范专科学校附属中学2022-2023学年高二下学期4月月考化学试题河南省洛阳市创新发展联盟2022-2023学年高二下学期3月联考化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(结构与性质)陕西省西安中学2023-2024学年高三上学期8月月考化学试题



