名校
1 . 工业上,处理低晶位黄铜矿[二硫化亚铁铜(CuFeS2)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(FeSO4·7H2O)和胆矾(CuSO4·5H2O),相关流程如图。
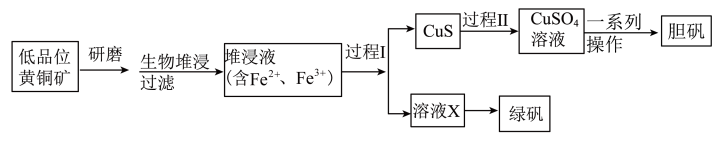
(1)基态Cu2+核外电子的空间运动状态有_______ 种。
(2)生物堆浸过程的反应在T·f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为CuFeS2+4H++O2 Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为_______ 。
(3)过程Ⅰ需将Fe3+还原为Fe2+,请回答下列问题:
①若过程Ⅰ中只加入了一种试剂,在下列常见试剂中可选择_______ (填序号)。
a.Na2S b.Na2SO3 c.Na2S2O3 d.Cu
②若过程Ⅰ加入了过量的Na2S2O3作为还原剂,在该酸性环境中发生反应的离子方程式有_______ (已知: 作还原剂时,通常被氧化为
作还原剂时,通常被氧化为 ,忽略该过程中所有涉及配合物的反应)。
,忽略该过程中所有涉及配合物的反应)。
(4)向过程Ⅰ所得的CuS固体中加H2O2和稀硫酸,使CuS完全溶解,其中H2O2的作用是_______ (填“氧化剂”或“还原剂”)。
(5)制备胆矾的“一系列操作”包含_______ 、过滤、洗涤、干燥。
(6)绿矾的纯度可通过“KMnO4滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量MnSO4固体作催化剂。用物质的量浓度为cmol/L的KMnO4溶液滴定。滴定终点的现象为_______ ,此时,消耗KMnO4溶液的体积为VmL,则绿矾晶体质量分数的计算式为_______ 。(FeSO4·7H2O摩尔质量为278g/mol)

(1)基态Cu2+核外电子的空间运动状态有
(2)生物堆浸过程的反应在T·f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为CuFeS2+4H++O2
 Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为(3)过程Ⅰ需将Fe3+还原为Fe2+,请回答下列问题:
①若过程Ⅰ中只加入了一种试剂,在下列常见试剂中可选择
a.Na2S b.Na2SO3 c.Na2S2O3 d.Cu
②若过程Ⅰ加入了过量的Na2S2O3作为还原剂,在该酸性环境中发生反应的离子方程式有
 作还原剂时,通常被氧化为
作还原剂时,通常被氧化为 ,忽略该过程中所有涉及配合物的反应)。
,忽略该过程中所有涉及配合物的反应)。(4)向过程Ⅰ所得的CuS固体中加H2O2和稀硫酸,使CuS完全溶解,其中H2O2的作用是
(5)制备胆矾的“一系列操作”包含
(6)绿矾的纯度可通过“KMnO4滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量MnSO4固体作催化剂。用物质的量浓度为cmol/L的KMnO4溶液滴定。滴定终点的现象为
您最近一年使用:0次
2 . 我国科学家用粗氢氧化高钴 制备硫酸钴晶体(
制备硫酸钴晶体(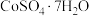 ),其工艺流程如下:
),其工艺流程如下:

已知:ⅰ.还原浸出液中的阳离子有: 、
、 、
、 和
和 等
等
ⅱ.部分物质的溶度积常数(25℃)
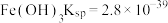
ⅲ.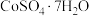 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大
(1)Co元素位于元素周期表的_______ 区,基态Co原子的核外电子排布式为_______ 。
(2)浸出 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为_______ 。
(3)写出“氧化沉铁”的离子方程式_______ ,25℃时,浊液中铁离子浓度为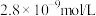 ,此时溶液
,此时溶液
_______ 。
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因_______ 。
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为: 。
。
已知:铁氰化钾标准液浓度为 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为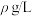 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗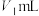 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。
计算样品中钴含量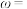
_______ (以钴的质量分数 计)。
计)。
(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为_______ 。已知:晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高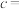
_______  (列出计算式)。
(列出计算式)。

 制备硫酸钴晶体(
制备硫酸钴晶体(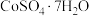 ),其工艺流程如下:
),其工艺流程如下:
已知:ⅰ.还原浸出液中的阳离子有:
 、
、 、
、 和
和 等
等ⅱ.部分物质的溶度积常数(25℃)

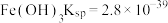
ⅲ.
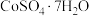 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大(1)Co元素位于元素周期表的
(2)浸出
 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为(3)写出“氧化沉铁”的离子方程式
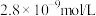 ,此时溶液
,此时溶液
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:
 。
。已知:铁氰化钾标准液浓度为
 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为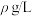 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗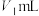 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。计算样品中钴含量
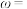
 计)。
计)。(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高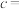
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
3 . 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。
(1)Mn2+的价电子排布式为_______ 。
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为_______ 。
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是_______ ,实验Ⅱ中发生反应的离子方程式为_______ 。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是_______ 。
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为_______ 。

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为_______ 。(写出计算过程)

(1)Mn2+的价电子排布式为
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为
您最近一年使用:0次
解题方法
4 . 一种以低品位菱锰矿(含 和少量钙、铝的碳酸盐及
和少量钙、铝的碳酸盐及 等)为主要原料制备
等)为主要原料制备 的流程如下。
的流程如下。
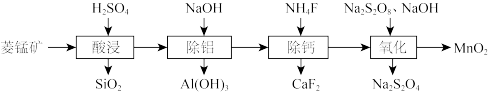
(1)基态 核外电子排布式为
核外电子排布式为_______ 。
(2)已知常温下: ,
, ,取“除钙”后得到的
,取“除钙”后得到的
 ,向其中加入
,向其中加入
 ,再加入
,再加入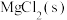 充分搅拌至
充分搅拌至 完全转化,至少需要加入
完全转化,至少需要加入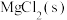 的物质的量为
的物质的量为_______ mol(溶液体积变化忽略不计)。
(3)常温下, 在含
在含 的水溶液中会产生具有强氧化性的自由基·
的水溶液中会产生具有强氧化性的自由基· 。
。
①写出“氧化”时· 与
与 的发生反应的离子方程式:
的发生反应的离子方程式:_______ 。
②当 和
和 的用量一定时,
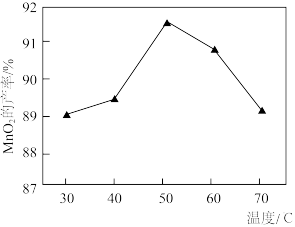
的用量一定时, 的产率随温度的变化如图所示,相同时间内,50℃下
的产率随温度的变化如图所示,相同时间内,50℃下 的产率高于40℃和60℃时的产率,原因分别是
的产率高于40℃和60℃时的产率,原因分别是_______ 。
(4) 含量测定:称取
含量测定:称取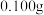
 样品,加入
样品,加入
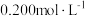 的
的 溶液和适量
溶液和适量 溶液,加热使
溶液,加热使 充分转化为
充分转化为 溶液。冷却后,向溶液中加入
溶液。冷却后,向溶液中加入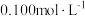 的
的 溶液滴定过量
溶液滴定过量 ,消耗
,消耗 溶液
溶液 。计算样品中
。计算样品中 的质量分数。
的质量分数。______ (写出计算过程),已知: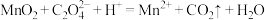 ;
;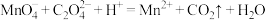 。(方程式均未配平)
。(方程式均未配平)
 和少量钙、铝的碳酸盐及
和少量钙、铝的碳酸盐及 等)为主要原料制备
等)为主要原料制备 的流程如下。
的流程如下。
(1)基态
 核外电子排布式为
核外电子排布式为(2)已知常温下:
 ,
, ,取“除钙”后得到的
,取“除钙”后得到的
 ,向其中加入
,向其中加入
 ,再加入
,再加入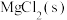 充分搅拌至
充分搅拌至 完全转化,至少需要加入
完全转化,至少需要加入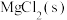 的物质的量为
的物质的量为(3)常温下,
 在含
在含 的水溶液中会产生具有强氧化性的自由基·
的水溶液中会产生具有强氧化性的自由基· 。
。①写出“氧化”时·
 与
与 的发生反应的离子方程式:
的发生反应的离子方程式:②当
 和
和 的用量一定时,
的用量一定时, 的产率随温度的变化如图所示,相同时间内,50℃下
的产率随温度的变化如图所示,相同时间内,50℃下 的产率高于40℃和60℃时的产率,原因分别是
的产率高于40℃和60℃时的产率,原因分别是
(4)
 含量测定:称取
含量测定:称取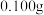
 样品,加入
样品,加入
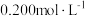 的
的 溶液和适量
溶液和适量 溶液,加热使
溶液,加热使 充分转化为
充分转化为 溶液。冷却后,向溶液中加入
溶液。冷却后,向溶液中加入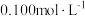 的
的 溶液滴定过量
溶液滴定过量 ,消耗
,消耗 溶液
溶液 。计算样品中
。计算样品中 的质量分数。
的质量分数。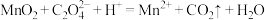 ;
;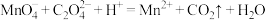 。(方程式均未配平)
。(方程式均未配平)
您最近一年使用:0次
名校
5 . X、Y、Z、Q四种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳中含量(质量分数)最多的元素,Q的核电荷数是X与Z的核电荷数之和。请回答下列问题。
(1)X、Y的元素符号依次为___________ 、___________ 。
(2)XZ2与YZ2分别属于___________ (填“极性分子”或“非极性分子”,下同)和___________ 。
(3)Q的元素符号是___________ ,它位于第___________ 周期,它的基态原子的核外电子排布式为___________ ,在形成化合物时它的最高化合价为___________ 。
(1)X、Y的元素符号依次为
(2)XZ2与YZ2分别属于
(3)Q的元素符号是
您最近一年使用:0次
2021-07-09更新
|
85次组卷
|
3卷引用:云南省元阳县一中2020-2021学年高二下学期6月份考试化学试题
6 . X、Y、Z、Q、E五种元素中,X原子核外的M层只有两对成对电子,Y原子的核外L层电子数是K层的两倍,Z是地壳中含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大,F元素的基态原子的最外层有3个未成对电子,次外层有2个电子,请回答下列问题:
(1)X、Y、F的元素符号分别是_____ 、______ 、____ ,XZ2与YZ2的分子式分别为______ 和_____ 。
(2)Q的元素符号是___________ ,它位于第________ 周期,它的核外电子排布式为_____ ,在形成化合物时它最高的化合价为_______ 。
(3)E的单质与水反应的化学方程式为___________ 。
(1)X、Y、F的元素符号分别是
(2)Q的元素符号是
(3)E的单质与水反应的化学方程式为
您最近一年使用:0次
解题方法
7 . 硒被誉为“生命元素”。亚硒酸钙(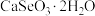 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
①含硒废料的主要成分是 和
和 ;“焙烧”时固体产物为
;“焙烧”时固体产物为 、
、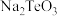 和
和 。
。
② 易溶于水,
易溶于水, 难溶于水。
难溶于水。
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为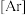
___________ 。
(2)利用“浸渣”可以制备胆矾,其操作步骤是加入足量稀硫酸溶解,再通入热空气。通入热空气的目的是___________ (用离子方程式表示)。
(3)上述参加反应的双氧水远小于实际消耗的双氧水(反应温度在 ),其主要原因是
),其主要原因是___________ 。
(4)硒酸分解制备 的副产物有
的副产物有___________ (填化学式)。
(5)已知 、
、 的熔点分别为
的熔点分别为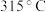 、
、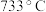 ,其熔点差异的主要原因是
,其熔点差异的主要原因是___________ 。
(6)测定 产品纯度。称取
产品纯度。称取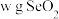 产品溶于水配制成
产品溶于水配制成 溶液,取
溶液,取 于锥形瓶中,加入足量
于锥形瓶中,加入足量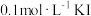 溶液和适量稀硝酸,充分反应后,滴加3滴
溶液和适量稀硝酸,充分反应后,滴加3滴 淀粉溶液,用
淀粉溶液,用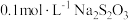 溶液滴定至终点时消耗
溶液滴定至终点时消耗 滴定液。发生有关反应:
滴定液。发生有关反应:
①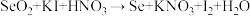 (未配平)
(未配平)
②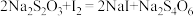
该 产品中硒元素的质量分数为
产品中硒元素的质量分数为___________ %。如果大量空气进入锥形瓶,可能导致测得的结果___________ (填“偏高”“偏低”或“无影响”)。
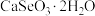 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题: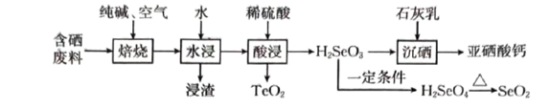
①含硒废料的主要成分是
 和
和 ;“焙烧”时固体产物为
;“焙烧”时固体产物为 、
、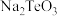 和
和 。
。②
 易溶于水,
易溶于水, 难溶于水。
难溶于水。(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为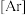
(2)利用“浸渣”可以制备胆矾,其操作步骤是加入足量稀硫酸溶解,再通入热空气。通入热空气的目的是
(3)上述参加反应的双氧水远小于实际消耗的双氧水(反应温度在
 ),其主要原因是
),其主要原因是(4)硒酸分解制备
 的副产物有
的副产物有(5)已知
 、
、 的熔点分别为
的熔点分别为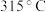 、
、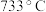 ,其熔点差异的主要原因是
,其熔点差异的主要原因是(6)测定
 产品纯度。称取
产品纯度。称取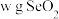 产品溶于水配制成
产品溶于水配制成 溶液,取
溶液,取 于锥形瓶中,加入足量
于锥形瓶中,加入足量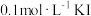 溶液和适量稀硝酸,充分反应后,滴加3滴
溶液和适量稀硝酸,充分反应后,滴加3滴 淀粉溶液,用
淀粉溶液,用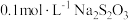 溶液滴定至终点时消耗
溶液滴定至终点时消耗 滴定液。发生有关反应:
滴定液。发生有关反应:①
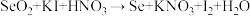 (未配平)
(未配平)②
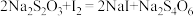
该
 产品中硒元素的质量分数为
产品中硒元素的质量分数为
您最近一年使用:0次
名校
解题方法
8 . 硒被誉为“生命元素”。亚硒酸钙(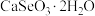 ,难溶于水)常用作饲料添加剂,
,难溶于水)常用作饲料添加剂, 常用作制备含硒营养物质的原料。一种利用含硒废料(主要成分是
常用作制备含硒营养物质的原料。一种利用含硒废料(主要成分是 和
和 )制备亚硒酸钙和二氧化硒的工艺流程如下。
)制备亚硒酸钙和二氧化硒的工艺流程如下。
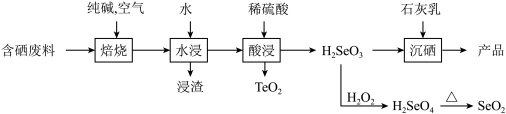
回答下列问题:
(1)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部充入,这样操作的目的是_______ ;“焙烧”中固体产物为 和
和 ,“焙烧”时
,“焙烧”时 反应的化学方程式为
反应的化学方程式为_______ 。
(2)水浸时浸渣的主要成分是_______ (填化学式)。
(3)“沉硒”的化学方程式为________ 。
(4)基态 原子核外电子排布式为
原子核外电子排布式为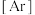
_______ 。
(5)已知 熔点为
熔点为 ,
, 时升华,则
时升华,则 形成的晶体类型为
形成的晶体类型为______ 。
(6)测定 产品纯度。
产品纯度。
称取 产品溶于水,加入足量
产品溶于水,加入足量 溶液和适量稀盐酸,充分反应后,用
溶液和适量稀盐酸,充分反应后,用 标准溶液滴定至终点时消耗
标准溶液滴定至终点时消耗 滴定液。
滴定液。
发生有关反应:① (未配平);
(未配平);
② 。
。
在下列试剂中,宜选择的指示剂为_____ (填标号)。 产品中
产品中 的质量分数为
的质量分数为______  。
。
A. 溶液 B.
溶液 B. 淀粉溶液
淀粉溶液
C. 酚酞溶液 D.
酚酞溶液 D. 甲基橙溶液
甲基橙溶液
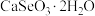 ,难溶于水)常用作饲料添加剂,
,难溶于水)常用作饲料添加剂, 常用作制备含硒营养物质的原料。一种利用含硒废料(主要成分是
常用作制备含硒营养物质的原料。一种利用含硒废料(主要成分是 和
和 )制备亚硒酸钙和二氧化硒的工艺流程如下。
)制备亚硒酸钙和二氧化硒的工艺流程如下。
回答下列问题:
(1)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部充入,这样操作的目的是
 和
和 ,“焙烧”时
,“焙烧”时 反应的化学方程式为
反应的化学方程式为(2)水浸时浸渣的主要成分是
(3)“沉硒”的化学方程式为
(4)基态
 原子核外电子排布式为
原子核外电子排布式为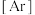
(5)已知
 熔点为
熔点为 ,
, 时升华,则
时升华,则 形成的晶体类型为
形成的晶体类型为(6)测定
 产品纯度。
产品纯度。称取
 产品溶于水,加入足量
产品溶于水,加入足量 溶液和适量稀盐酸,充分反应后,用
溶液和适量稀盐酸,充分反应后,用 标准溶液滴定至终点时消耗
标准溶液滴定至终点时消耗 滴定液。
滴定液。发生有关反应:①
 (未配平);
(未配平);②
 。
。在下列试剂中,宜选择的指示剂为
 产品中
产品中 的质量分数为
的质量分数为 。
。A.
 溶液 B.
溶液 B. 淀粉溶液
淀粉溶液C.
 酚酞溶液 D.
酚酞溶液 D. 甲基橙溶液
甲基橙溶液
您最近一年使用:0次
2024-02-13更新
|
155次组卷
|
2卷引用:河北省沧州市泊头市部分学校2023-2024学年高三上学期12月月考化学试题
9 . 某厂利用废旧铅蓄电池中的铅膏(主要成分为 、
、 、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:
、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:

已知: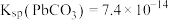 ,
,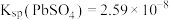 ,
,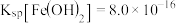 ,
,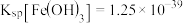 ,
,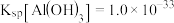 。
。
(1)PbO中O元素的价电子的轨道表示式为_______________________ 。
(2)“脱硫”过程中涉及含Pb沉淀转化的离子方程式为___________ ,反应的平衡常数K的数值为_____________ 。
(3)“酸浸”时, 能使
能使 转化为
转化为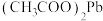 ,写出该反应的化学方程式
,写出该反应的化学方程式_________________ 此外, 还能氧化溶液中的
还能氧化溶液中的_____________ (填化学式或离子符号)。
(4)PbO的溶解度曲线如图甲所示,结合图像分析,为得到高纯PbO固体,需将粗品PbO溶解在__________ (填“10%”或“35%”)浓度的NaOH溶液中,加热至110℃,充分溶解后趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯产品。

(5)常温下,溶液中部分含铅物质的质量分数 与溶液pH变化的关系如图乙所示:
与溶液pH变化的关系如图乙所示:

①若溶液pH由10增大到了11,发生反应的离子方程式为_______________________ 。
②“除杂”时,为了使 、
、 沉淀完全(离子浓度低于
沉淀完全(离子浓度低于 ),结合图乙与已知的信息,需调节溶液pH的理论范围为
),结合图乙与已知的信息,需调节溶液pH的理论范围为____________ 。
 、
、 、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:
、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:
已知:
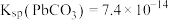 ,
,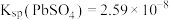 ,
,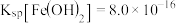 ,
,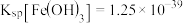 ,
,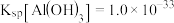 。
。(1)PbO中O元素的价电子的轨道表示式为
(2)“脱硫”过程中涉及含Pb沉淀转化的离子方程式为
(3)“酸浸”时,
 能使
能使 转化为
转化为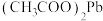 ,写出该反应的化学方程式
,写出该反应的化学方程式 还能氧化溶液中的
还能氧化溶液中的(4)PbO的溶解度曲线如图甲所示,结合图像分析,为得到高纯PbO固体,需将粗品PbO溶解在

(5)常温下,溶液中部分含铅物质的质量分数
 与溶液pH变化的关系如图乙所示:
与溶液pH变化的关系如图乙所示:
①若溶液pH由10增大到了11,发生反应的离子方程式为
②“除杂”时,为了使
 、
、 沉淀完全(离子浓度低于
沉淀完全(离子浓度低于 ),结合图乙与已知的信息,需调节溶液pH的理论范围为
),结合图乙与已知的信息,需调节溶液pH的理论范围为
您最近一年使用:0次
2023-12-12更新
|
300次组卷
|
2卷引用:重庆市育才中学校、西南大学附中、万州中学2023-2024学年高二上学期12月联考化学试题
名校
解题方法
10 . 三氯化铬( )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备 和
和 。
。
(1)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序___________ 。
(2)制备 。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。
①上述反应的化学方程式为___________ 。
②上述反应中的乙醇与BaCrO4投料的物质的量比例大约为3:8,原因是___________ 。
(3)测定 的质量分数。
的质量分数。
Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。
Ⅲ.加入1mL淀粉溶液,用0.0250 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。
已知反应: (未配平) ;
(未配平) ; (未配平)
(未配平)
①滴定终点的现象是___________ 。
②计算 的质量分数(写出计算过程)
的质量分数(写出计算过程)___________ 。
(4)制备 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。

请补充完整由 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液,___________ ,低温烘干,得到 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
 )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备 和
和 。
。(1)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序
(2)制备
 。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。①上述反应的化学方程式为
②上述反应中的乙醇与BaCrO4投料的物质的量比例大约为3:8,原因是
(3)测定
 的质量分数。
的质量分数。Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的
 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。Ⅲ.加入1mL淀粉溶液,用0.0250
 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。已知反应:
 (未配平) ;
(未配平) ; (未配平)
(未配平)①滴定终点的现象是
②计算
 的质量分数(写出计算过程)
的质量分数(写出计算过程)(4)制备
 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
请补充完整由
 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液, 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
您最近一年使用:0次



