名校
解题方法
1 . 现有A、B、C、D四种元素,A是第五周期第ⅠA族元素,B是第三周期元素。B、C、D的最外层电子分别为2、2和7个。四种元素原子序数从小到大的顺序是B、C、D、A。已知C和D的次外层电子均为18个。
(1)写出A、B、C、D的元素符号A:_______ B:_______ C:_______ D:_______ 。
(2)写出B原子的电子排布式:_______ ;A、C、D的价电子排布式A:_______ C:_______ D:_______ 。
(3)写出碱性最强的最高价氧化物的水化物的化学式:_______ 。
(4)写出酸性最强的最高价氧化物的水化物的化学式:_______ 。
(1)写出A、B、C、D的元素符号A:
(2)写出B原子的电子排布式:
(3)写出碱性最强的最高价氧化物的水化物的化学式:
(4)写出酸性最强的最高价氧化物的水化物的化学式:
您最近一年使用:0次
2022-03-31更新
|
96次组卷
|
4卷引用:云南省楚雄彝族自治州民族中学2021-2022学年高二下学期3月月考化学试题
名校
解题方法
2 . A、B、C、D四种短周期元素,原子序数依次增大,已知A是自然界中含量最多的元素;B、C、D同周期,且B在同周期元素中第一电离能最小;C的第一、二、三电离能分别为738kJ·mol-1、1451kJ·mol-1、7733kJ·mol-1;D在同周期元素中(除稀有气体元素外)第一电离能最大。
(1)试推断该四种元素并写出元素符号:A_______ ;B_______ ;C_______ ;D_______ 。
(2)写出A、B、C三种元素两两组成的所有化合物的化学式:_______ 。
(3)写出电解CD2的化学方程式:_______ 。
(1)试推断该四种元素并写出元素符号:A
(2)写出A、B、C三种元素两两组成的所有化合物的化学式:
(3)写出电解CD2的化学方程式:
您最近一年使用:0次
2022-03-31更新
|
34次组卷
|
3卷引用:云南省楚雄彝族自治州民族中学2021-2022学年高二下学期3月月考化学试题
名校
解题方法
3 . 20世纪80年代至今,超分子化学在识别、催化、传输等功能方面迅速渗透到各学科领域。一种由 、
、 、
、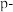 甲酸丁酯吡啶及
甲酸丁酯吡啶及 通过配位键形成的超分子结构如图所示。回答下列问题:
通过配位键形成的超分子结构如图所示。回答下列问题:

(1)写出超分子的两个重要特征_______ 。如图超分子中存在的化学键类型有_______ 。
a.离子键 b.配位键 c.氢键 d.分子间力
(2)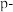 甲酸丁酯吡啶分子(
甲酸丁酯吡啶分子(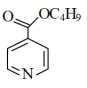 )中碳原子的杂化方式有
)中碳原子的杂化方式有_______ 。
(3) 的基态价电子排布图为
的基态价电子排布图为_______ ;基态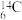 原子核外存在
原子核外存在_______ 对自旋相反的电子。
(4)吡啶(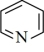 )是类似于苯的芳香族化合物。
)是类似于苯的芳香族化合物。 吡啶分子中含有的
吡啶分子中含有的 键数目为
键数目为_______ 。广义酸碱理论认为:凡能给出质子( )的任何分子或离子都是酸;凡能结合质子(
)的任何分子或离子都是酸;凡能结合质子( )的分子或离子都是碱。按此理论,吡啶(
)的分子或离子都是碱。按此理论,吡啶(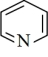 )属于
)属于_______ (填“酸”“碱”或“盐”).
(5) 的晶胞(如下图Ⅰ)与干冰的晶胞(如下图Ⅱ)相似,则每个
的晶胞(如下图Ⅰ)与干冰的晶胞(如下图Ⅱ)相似,则每个 分子周围与它最近距离且等距离的
分子周围与它最近距离且等距离的 分子有
分子有_______ 个;已知 晶体密度为
晶体密度为 ,则两个最近
,则两个最近 分子间的距离为
分子间的距离为_______ nm( 代表阿伏加德罗常数的值,用含
代表阿伏加德罗常数的值,用含 、
、 的代数式表示)。
的代数式表示)。

 、
、 、
、 甲酸丁酯吡啶及
甲酸丁酯吡啶及 通过配位键形成的超分子结构如图所示。回答下列问题:
通过配位键形成的超分子结构如图所示。回答下列问题:
(1)写出超分子的两个重要特征
a.离子键 b.配位键 c.氢键 d.分子间力
(2)
 甲酸丁酯吡啶分子(
甲酸丁酯吡啶分子( )中碳原子的杂化方式有
)中碳原子的杂化方式有(3)
 的基态价电子排布图为
的基态价电子排布图为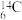 原子核外存在
原子核外存在(4)吡啶(
 )是类似于苯的芳香族化合物。
)是类似于苯的芳香族化合物。 吡啶分子中含有的
吡啶分子中含有的 键数目为
键数目为 )的任何分子或离子都是酸;凡能结合质子(
)的任何分子或离子都是酸;凡能结合质子( )的分子或离子都是碱。按此理论,吡啶(
)的分子或离子都是碱。按此理论,吡啶( )属于
)属于(5)
 的晶胞(如下图Ⅰ)与干冰的晶胞(如下图Ⅱ)相似,则每个
的晶胞(如下图Ⅰ)与干冰的晶胞(如下图Ⅱ)相似,则每个 分子周围与它最近距离且等距离的
分子周围与它最近距离且等距离的 分子有
分子有 晶体密度为
晶体密度为 ,则两个最近
,则两个最近 分子间的距离为
分子间的距离为 代表阿伏加德罗常数的值,用含
代表阿伏加德罗常数的值,用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
4 . 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
则A的化合价___________ B的化合价(填“>”、“<”或“=”)。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:
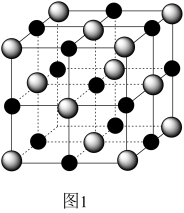
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:___________ 。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________ 。
(4)某配合物的分子结构如图2所示,则N原子的杂化方式为___________ ;基态Ni原子的电子排布式___________ 。
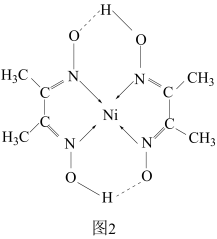
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/ kJ/mol | 786 | 715 | 3401 |
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(4)某配合物的分子结构如图2所示,则N原子的杂化方式为

您最近一年使用:0次
名校
解题方法
5 . 碳、氮、铜形成的单质及它们形成的化合物有重要研究和应用价值,回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
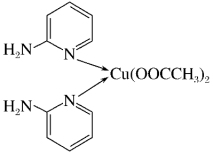
①基态Cu原子的价电子排布式为___________ ,在元素周期表中铜位于___________ 区(填“s”“p”“d”或“ds”)。
②C、N、O三种元素的第一电离能由大到小的顺序为___________ 。
③邻氨基吡啶的铜配合物中,Cu2+的配位数是________ ,N原子的杂化类型为_________ 。
(2)C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。
①有关C60和N60的说法中正确的是___________ 。
A.C60和N60均属于分子晶体 B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化 D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为___________ (填“极性键”“非极性键”)。
(3)原子坐标参数和晶胞参数是晶胞的两个基本参数。

①图a中原子坐标参数分别为:A(0,0,0),B( ,
, ,0),C(
,0),C( ,0,
,0, ),则D的原子坐标参数为
),则D的原子坐标参数为___________ 。
②图b为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为______ g·cm-3(用含R、NA的式子表示)。
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①基态Cu原子的价电子排布式为
②C、N、O三种元素的第一电离能由大到小的顺序为
③邻氨基吡啶的铜配合物中,Cu2+的配位数是
(2)C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。
①有关C60和N60的说法中正确的是
A.C60和N60均属于分子晶体 B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化 D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为
(3)原子坐标参数和晶胞参数是晶胞的两个基本参数。

①图a中原子坐标参数分别为:A(0,0,0),B(
 ,
, ,0),C(
,0),C( ,0,
,0, ),则D的原子坐标参数为
),则D的原子坐标参数为②图b为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为
您最近一年使用:0次
解题方法
6 . (CH3NH3)PbI3作为最典型的有机金属卤化物,一直是太阳能电池研究的宠儿。回答下列问题:
(1)基态Pb原子的价电子排布式为___________ ,N能层电子数有___________ 个。
(2)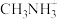 中第一电离能最大的元素是
中第一电离能最大的元素是___________ (填元素符号),该离子中的化学键是由___________ (填标号)原子轨道重叠形成的。
a.sp2与sp2 b.sp3与sp c.sp3与sp3 d.sp3与s e.s与s
(3) 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是_______ (填“sp3”、“sp”、“sp3d”或“sp3d2”)。 的空间构型为
的空间构型为______ 。
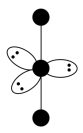
(4)PbF4的熔点显著高于PbCl4的原因是_______ 。
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示),Pb2+周围距离最近且相等的I-数目有______ 个。若将A离子作为晶胞的体心另取晶胞Y,则I处于晶胞Y中的______ ,晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=______ g▪cm-3(列出计算式,设NA为阿伏加德罗常数的值)。

(1)基态Pb原子的价电子排布式为
(2)
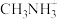 中第一电离能最大的元素是
中第一电离能最大的元素是a.sp2与sp2 b.sp3与sp c.sp3与sp3 d.sp3与s e.s与s
(3)
 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是 的空间构型为
的空间构型为
(4)PbF4的熔点显著高于PbCl4的原因是
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示),Pb2+周围距离最近且相等的I-数目有

您最近一年使用:0次
2022-03-14更新
|
648次组卷
|
5卷引用:云南省2022届高三第一次统一检测(一模)理综化学试题
云南省2022届高三第一次统一检测(一模)理综化学试题(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)2024届四川省宜宾市叙州区第二中学校高三上学期一诊模拟考试理综试题
名校
7 . X、Y、Z为短周期元素,X原子的质子数等于Z与Y的质子数之和,Z与Y位于同一周期,Y原子核外有3个未成对电子,非金属Z的一种固体单质可导电。回答下列问题:
(1)Y在周期表中的位置是第____ 周期第____ 族,其原子结构示意图为___ ;Y与Z之间形成的化学键属于___ 。
(2)X、Y、Z三种元素中原子半径最大的是____ (填元素符号);X单质既可与盐酸反应,又可溶于氢氧化钠溶液,产生的气体为____ (填分子式),Z元素最简单的气态氢化物的分子空间构型为____ 。
(3)Z的最高价氧化物的电子式为____ 。
(1)Y在周期表中的位置是第
(2)X、Y、Z三种元素中原子半径最大的是
(3)Z的最高价氧化物的电子式为
您最近一年使用:0次
名校
解题方法
8 . 钇(Y)是一种用途广泛的金属,是稀土元素之一,钇钡铜氧化物是一种高温超导材料。回答下列问题:
(1)钇的原子序数为39,其基态原子的外围电子排布式为________ ;钡、铜的焰色对应的辐射波长Ba____ Cu(填“大于”或“小于”)。
(2)(C4H9O)3PO(磷酸三丁酯)是一种提炼稀土常用的萃取剂,其四种组成元素中,电负性最大的是______ ;(C4H9O)3PO中P原子的轨道杂化类型为______ 。
(3)Y和Cu都可形成配合物。向CuSO4溶液中滴加氨水,先生成蓝色沉淀,后蓝色沉淀溶解得到[Cu(NH3)4]SO4深蓝色透明溶液。若[Cu(NH3)4]2+中的两个NH3被两个NH2R替换,得到两种不同构型的产物,则[Cu(NH3)4]2+的空间构型为_____ ,其判断理由是_______ ;若向[Cu(NH3)4]SO4溶液中加入乙醇,将析出深蓝色晶体,[Cu(NH3)4]SO4难溶于乙醇的原因可能是____________ .
(4)某种由Y、Ba、Cu、O构成的超导化合物的晶胞结构如图所示。
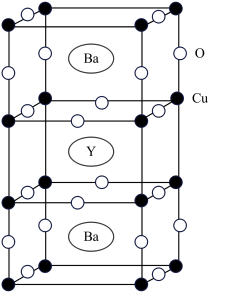
①该化合物中,Y、Ba的化合价分别为+3、+2,Cu的平均化合价为_________ 。
②已知:晶胞参数为a=381.7 pm、b=388.3 pm、c=1163.3 pm,α=β=γ=90°,设NA为阿伏加德罗常数的值,则该晶体的密度为______ g.cm-3(列出计算式即可)。
(1)钇的原子序数为39,其基态原子的外围电子排布式为
(2)(C4H9O)3PO(磷酸三丁酯)是一种提炼稀土常用的萃取剂,其四种组成元素中,电负性最大的是
(3)Y和Cu都可形成配合物。向CuSO4溶液中滴加氨水,先生成蓝色沉淀,后蓝色沉淀溶解得到[Cu(NH3)4]SO4深蓝色透明溶液。若[Cu(NH3)4]2+中的两个NH3被两个NH2R替换,得到两种不同构型的产物,则[Cu(NH3)4]2+的空间构型为
(4)某种由Y、Ba、Cu、O构成的超导化合物的晶胞结构如图所示。

①该化合物中,Y、Ba的化合价分别为+3、+2,Cu的平均化合价为
②已知:晶胞参数为a=381.7 pm、b=388.3 pm、c=1163.3 pm,α=β=γ=90°,设NA为阿伏加德罗常数的值,则该晶体的密度为
您最近一年使用:0次
2022-03-10更新
|
531次组卷
|
4卷引用:云南省昆明一中、宁夏银川一中2021-2022学年高三下学期联合考试一模理科综合化学试题
云南省昆明一中、宁夏银川一中2021-2022学年高三下学期联合考试一模理科综合化学试题(已下线)二轮拔高卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)黑龙江省齐齐哈尔市第一中学校2022届高三下学期二模理科综合化学试题吉林市第一中学2021-2022学年高三下学期4月教学质量检测理科综合化学试题
9 . 南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐(N5)6(H3O)3(NH4)4Cl,时隔不久,他们又成功制得全氮阴离子(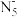 )金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
)金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
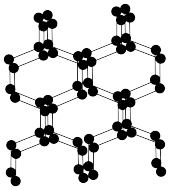
(1)基态氨原子最高能层电子所占用能级的电子云形状为___________ 。与N2互为等电子体的全氧离子化学式为___________ ;具有空间网状结构的高聚氮结构如图所示,则N70的端点小于高聚氮的沸点,原因是___________ ;N70和高聚氮属于___________ (填序号)。
A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氙化物见研究较早的含全氮阴离子的化合物,如:氢叠氦酸(HN3)、叠氮化钠(NaN3)等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钻的配体是NH3和______ , 的立体构型为
的立体构型为_______ 。
(3)N2H4分子中N原子均采取_______ 杂化;NaN3的晶格能大于KN3的晶格能,原因是________ 。
(4)试就胡炳成教授团队合成的上述两种盐进行有关分析:
①热分析结果显示盐(N5)6(H3O)3(NH4)4Cl分解温度高达116.8吨,具有非常好的热稳定性。这与其结构中含有类似苯分子中的大π键有关。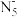 中的σ键总数为
中的σ键总数为___________ 个。
②试画出金属盐Co(N5)2(H2O)4·4H2O中钴离子的价电子排布图:___________
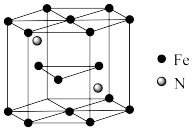
(5)一种氨铁化合物的结构如图所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为___________ g·cm-3。
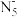 )金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
)金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:(1)基态氨原子最高能层电子所占用能级的电子云形状为

A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氙化物见研究较早的含全氮阴离子的化合物,如:氢叠氦酸(HN3)、叠氮化钠(NaN3)等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钻的配体是NH3和
 的立体构型为
的立体构型为(3)N2H4分子中N原子均采取
(4)试就胡炳成教授团队合成的上述两种盐进行有关分析:
①热分析结果显示盐(N5)6(H3O)3(NH4)4Cl分解温度高达116.8吨,具有非常好的热稳定性。这与其结构中含有类似苯分子中的大π键有关。
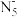 中的σ键总数为
中的σ键总数为②试画出金属盐Co(N5)2(H2O)4·4H2O中钴离子的价电子排布图:
(5)一种氨铁化合物的结构如图所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为

您最近一年使用:0次
名校
10 . 由H、C、O、N、S、Cu等元素能形成多种物质,这些物质有许多用途。请回答下列问题:
(1)碳原子价层电子的轨道表达式为_______ ,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_______ 形。
(2)碳和氢形成的最简单碳正离子CH,其中心原子碳原子的杂化类型为_______ ,该阳离子的空间构型为_______ 。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O 比CuO更稳定的原因是_______ 。
(4)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)_______ I1(Cu) (填“大于”或“小于”),原因是_______ 。
(5)金属晶体铜的晶胞如图所示,其堆积模型是_______ ,铜原子间的最短距离为a pm,密度为 g·cm-1, NA为阿伏加德罗常数。铜的相对原子质量为
g·cm-1, NA为阿伏加德罗常数。铜的相对原子质量为_______ (用a、ρ、N,表示,写出计算式即可)。

(1)碳原子价层电子的轨道表达式为
(2)碳和氢形成的最简单碳正离子CH,其中心原子碳原子的杂化类型为
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O 比CuO更稳定的原因是
(4)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)
(5)金属晶体铜的晶胞如图所示,其堆积模型是
 g·cm-1, NA为阿伏加德罗常数。铜的相对原子质量为
g·cm-1, NA为阿伏加德罗常数。铜的相对原子质量为
您最近一年使用:0次



