名校
1 . 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
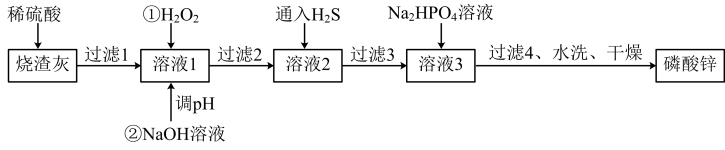
已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
(1)基态Zn原子的价电子排布式为______
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是______ (填一条)。
(3)加入H2O2的作用_______
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是______ 。
(5)加入Na2HPO4溶液发生反应的离子方程式为_____ 。
(6)洗涤磷酸锌沉淀时应选用____ (填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是_____ 。
(7)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=______ (已知:25°C时,H2S的电离平衡常数Ka1=1×10-7,Ka2=1×10-15)。

已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是
(3)加入H2O2的作用
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(5)加入Na2HPO4溶液发生反应的离子方程式为
(6)洗涤磷酸锌沉淀时应选用
(7)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=
您最近一年使用:0次
2022-08-25更新
|
492次组卷
|
3卷引用:云南师范大学附属中学2022-2023学年高三上学期高考适应性月考卷(二)理科综合化学试题
名校
2 . 前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)E的元素名称为_____ 。
(2)元素A、B、C中,电负性最大的是____ (填元素符号,下同),元素B、C、D第一电离能由大到小的顺序为____ 。
(3)与同族其他元素X形成的XA3相比,BA3易液化的原因是____ ;BA3分子中键角____ (填“>”“<”或“=”)109°28′。
(4)BC 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为____ ,BC 的空间结构为
的空间结构为_____ 。
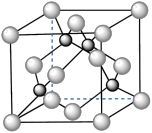
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为apm,则晶体的密度为____ g•cm-3(用NA表示阿伏加德罗常数的值)。
(1)E的元素名称为
(2)元素A、B、C中,电负性最大的是
(3)与同族其他元素X形成的XA3相比,BA3易液化的原因是
(4)BC
 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为 的空间结构为
的空间结构为(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为apm,则晶体的密度为

您最近一年使用:0次
2022-08-20更新
|
245次组卷
|
4卷引用:云南省西双版纳傣族自治州第一中学2022-2023学年高二下学期期末考试化学试题
名校
解题方法
3 . 硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题:
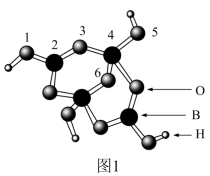
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为_______ ;4号硼原子参与形成的化学键有_______ ;m=_______ (填数字)。
(2)BN中B的化合价为_______ ,请解释原因:_______ 。
(3)BF3和过量NaF作用可生成NaBF4,BF 的立体构型为
的立体构型为_______ ;NaBF4的电子式为_______ 。
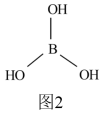
(4)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:_______
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为

(2)BN中B的化合价为
(3)BF3和过量NaF作用可生成NaBF4,BF
 的立体构型为
的立体构型为(4)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:

您最近一年使用:0次
解题方法
4 . 短周期元素A、B、C、D、E的原子序数依次增大,其最外层电子数与原子半径的大小关系如图所示,请按要求回答下列问题:
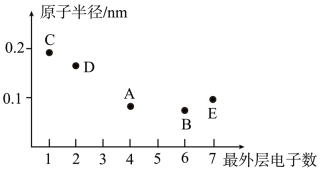
(1)基态E原子中有______ 种不同能量的电子,其中能量最高的电子所占据能级的电子云轮廓图呈______ 形。
(2)五种元素中,非金属元素第一电离能最小的是______ (填元素符号),非金属元素形成的最高价含氧酸的酸性最强的是______ (填化学式)。
(3)五种元素中,金属元素的金属性最强的是______ (填元素符号),设计一个简单的实验,证明金属元素金属性的强弱,简述实验步骤和现象:______ 。
(4)欲鉴定月球上是否有A元素的存在,可以通过______ 的方法。

(1)基态E原子中有
(2)五种元素中,非金属元素第一电离能最小的是
(3)五种元素中,金属元素的金属性最强的是
(4)欲鉴定月球上是否有A元素的存在,可以通过
您最近一年使用:0次
5 . 钨酸(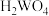 )是一种重要的化工原料,用作催化剂,制造防火材料等。一种以黑钨矿(主要成分是FeWO4和MnWO4,还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如图所示。
)是一种重要的化工原料,用作催化剂,制造防火材料等。一种以黑钨矿(主要成分是FeWO4和MnWO4,还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如图所示。
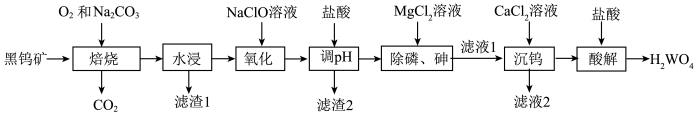
已知:①“滤渣1”的成分是Mn3O4和Fe2O3。
②“水浸”后滤液中主要阴离子为 、
、 、
、 、
、 和
和 。
。
③Ksp[Mg3(PO4)2]=1.0×10-24。
回答下列问题:
(1)基态As原子中未成对的电子数为_______ ,“滤渣2”的主要成分是_______ 。
(2)FeWO4发生“焙烧”时的化学反应方程式为_______ 。
(3)“除磷、砷”过程中P、As元素以Mg3(PO4)2和Mg3(AsO4)2形式沉淀,则“氧化”过程中加入 溶液的目的是
溶液的目的是_______ 。
(4)当“滤液1”中c(Mg2+)=1×10-6mol/L时,此时 是否沉淀完全。列式计算说明
是否沉淀完全。列式计算说明_______ 。
(5)“沉钨”后需要过滤、洗涤,则洗涤的具体操作为_______ 。
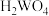 )是一种重要的化工原料,用作催化剂,制造防火材料等。一种以黑钨矿(主要成分是FeWO4和MnWO4,还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如图所示。
)是一种重要的化工原料,用作催化剂,制造防火材料等。一种以黑钨矿(主要成分是FeWO4和MnWO4,还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如图所示。
已知:①“滤渣1”的成分是Mn3O4和Fe2O3。
②“水浸”后滤液中主要阴离子为
 、
、 、
、 、
、 和
和 。
。③Ksp[Mg3(PO4)2]=1.0×10-24。
回答下列问题:
(1)基态As原子中未成对的电子数为
(2)FeWO4发生“焙烧”时的化学反应方程式为
(3)“除磷、砷”过程中P、As元素以Mg3(PO4)2和Mg3(AsO4)2形式沉淀,则“氧化”过程中加入
 溶液的目的是
溶液的目的是(4)当“滤液1”中c(Mg2+)=1×10-6mol/L时,此时
 是否沉淀完全。列式计算说明
是否沉淀完全。列式计算说明(5)“沉钨”后需要过滤、洗涤,则洗涤的具体操作为
您最近一年使用:0次
解题方法
6 . 下图是元素周期表中短周期的一部分,其中Y的氢化物能与其最高价含氧酸反应生成盐。回答下列问题:
(1)Y单质的电子式为_______ 。
(2)基态W原子的核外电子排布式为_______ 。
(3)过量X单质与Z的氧化物制取Z单质时,反应方程式为_______ 。
(4)将Q单质投入NaOH溶液中发生反应的离子方程式为_______ 。
| X | Y | ||
| Q | Z | W |
(2)基态W原子的核外电子排布式为
(3)过量X单质与Z的氧化物制取Z单质时,反应方程式为
(4)将Q单质投入NaOH溶液中发生反应的离子方程式为
您最近一年使用:0次
7 . A、B、C、D、E、F是6种原子序数依次增大的前四周期元素,部分元素性质或原子结构如下:
(1)E元素的基态原子的核外电子排布式为_______ 。
(2)用电子式表示化合物DC2的形成过程:_______ 。
(3)A、B、C三种元素简单氢化物的沸点由高到低的顺序为_______ (用化学式表示)。
(4)F元素的单质与A元素的最高价氧化物对应水化物的稀溶液反应的化学方程式为_______ 。
| 元素 | 元素性质或原子结构 |
| A | 基态原子价层电子排布为nsnnpn+1 |
| C | 元素周期表中电负性最大的元素 |
| D | 原子核外有三个电子层,且最外层电子数是核外电子总数的 |
| E | E3+的3d轨道为半充满状态 |
| F | 基态原子的M层全充满,N层只有一个电子 |
(2)用电子式表示化合物DC2的形成过程:
(3)A、B、C三种元素简单氢化物的沸点由高到低的顺序为
(4)F元素的单质与A元素的最高价氧化物对应水化物的稀溶液反应的化学方程式为
您最近一年使用:0次
2022-07-01更新
|
290次组卷
|
2卷引用:云南师范大学附属中学2023届高考适应性月考卷(一)化学试题
解题方法
8 . 云南省曲靖市物华天宝,资源丰富,煤炭、磷、铅、锌、锑等资源储量位居全省前列,会泽县“斑铜”技艺更是闻名全国。2021年12月,中国有色金属工业协会授予曲靖市“绿色晶硅光伏之都”称号。
(1)晶体硅中Si原子的杂化方式是____ ,基态Zn原子核外电子排布式为____ ,基态Cu原子核外有____ 种能量不同的电子。
(2)磷化亚铜(Cu3P)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化亚铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为____ ;Si、P、S的第一电离能(I1)由大到小的顺序为____ 。
(3)一种铜金合金具有储氢功能。其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为____ 。该储氢材料储氢时,氢分子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图1),该晶体储氢后的化学式为____ 。
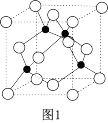
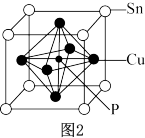
(4)磷青铜晶体的晶胞结构如图2所示,该晶体中P原子位于由铜原子形成的____ 的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为____ nm(用含NA的代数式表示)。
(1)晶体硅中Si原子的杂化方式是
(2)磷化亚铜(Cu3P)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化亚铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为
(3)一种铜金合金具有储氢功能。其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为

(4)磷青铜晶体的晶胞结构如图2所示,该晶体中P原子位于由铜原子形成的

您最近一年使用:0次
解题方法
9 . 胆矾化学式为CuSO4·5H2O。实验证明CuSO4·5H2O中有4个水分子为配位水分子,其结构示意图如下:回答下列问题:
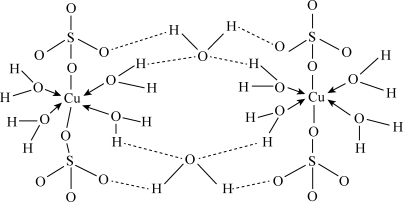
(1)基态铜原子的价层电子排布式为_______ ,位于周期表中第_______ 周期_______ 族。
(2)胆矾中S原子的杂化方式是_______ ,H、O、S中,第一电离能最大的元素是_______ (填元素符号)
(3)胆矾中存在的化学键有配位键、_______ 。
(4)含硫化合物SOCl2的VSEPR模型是_______ ,试分析该分子中键角∠Cl-S-O大于∠Cl-S-Cl的原因是_______ 。
(5)立方铜晶胞中铜原子的配位数为12,则每个晶胞中有_______ 个铜原子,铜原子的半径为rcm,则铜晶体的密度为_______ g·cm-3(阿伏加德罗常数值用NA表示)。

(1)基态铜原子的价层电子排布式为
(2)胆矾中S原子的杂化方式是
(3)胆矾中存在的化学键有配位键、
(4)含硫化合物SOCl2的VSEPR模型是
(5)立方铜晶胞中铜原子的配位数为12,则每个晶胞中有
您最近一年使用:0次
名校
10 . Na2FeO4、Li4Ti5O12和LiFePO4均可用作电极材料。请回答下列问题:
(1)基态Fe3+的核外电子排布式为_______ ;在同周期元素中,基态原子的未成对电子数与基态Fe3+相同的元素为_______ (填元素符号)。
(2) 的空间构型为
的空间构型为_______ ,其中P原子的杂化轨道类型为_______ ;写出一种与 互为等电子体且中心原子与P不同主族的阴离子:
互为等电子体且中心原子与P不同主族的阴离子:_______ (填离子符号)。
(3)[Ti(H2O)6]Cl3为紫色晶体,其中1 mol阳离子中所含σ键的数目为_______ ;[Ti(H2O)6]Cl3中存在的作用力类型有_______ (填字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
(4)已知物质间的转化关系如图甲所示,其中a、c均大于0。

①基态Na原子的第一电离能可表示为_______ 。
②相同条件下,K2O的晶格能_______ (填“>”“<”或“=”)c kJ·mol-1,原因为_______ 。
③Na2O的立方晶胞结构如图乙所示。若紧邻的两个Na+之间的距离为d pm,阿伏加德罗常数的值为NA,晶体的密度为ρg·cm-3,则Na2O的摩尔质量可表示为_______ g·mol-1(用含有d、ρ、NA的代数式表示)。

(1)基态Fe3+的核外电子排布式为
(2)
 的空间构型为
的空间构型为 互为等电子体且中心原子与P不同主族的阴离子:
互为等电子体且中心原子与P不同主族的阴离子:(3)[Ti(H2O)6]Cl3为紫色晶体,其中1 mol阳离子中所含σ键的数目为
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
(4)已知物质间的转化关系如图甲所示,其中a、c均大于0。

①基态Na原子的第一电离能可表示为
②相同条件下,K2O的晶格能
③Na2O的立方晶胞结构如图乙所示。若紧邻的两个Na+之间的距离为d pm,阿伏加德罗常数的值为NA,晶体的密度为ρg·cm-3,则Na2O的摩尔质量可表示为

您最近一年使用:0次
2022-05-10更新
|
433次组卷
|
3卷引用:云南省德宏州2021届高三上学期期末教学质量检测理综化学试题



