1 . 铜和三氧化二铁在工农业生产中用途广泛。用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
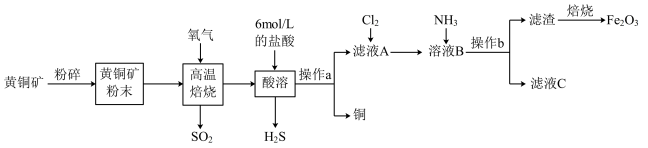
回答下列问题:
(1)铜的价电子排布式____________ 。
(2)高温焙烧时发生的反应是 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子____________ mol。
(3)向滤液A中通入 的目的是
的目的是________________________________________________ 。
(4)向溶液B中通入 后发生反应的离子方程式为
后发生反应的离子方程式为_____________________________________________ 。
(5)工业上用生物法处理 的原理为:(硫杆菌作催化剂)
的原理为:(硫杆菌作催化剂)
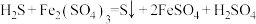
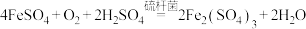
由图甲和图乙判断使用硫杆菌的最佳条件为___________________ 。若反应温度过高,反应速率下降,其原因是_______________________________________________ 。
 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
回答下列问题:
(1)铜的价电子排布式
(2)高温焙烧时发生的反应是
 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子(3)向滤液A中通入
 的目的是
的目的是(4)向溶液B中通入
 后发生反应的离子方程式为
后发生反应的离子方程式为(5)工业上用生物法处理
 的原理为:(硫杆菌作催化剂)
的原理为:(硫杆菌作催化剂)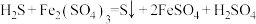
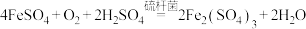
由图甲和图乙判断使用硫杆菌的最佳条件为

您最近一年使用:0次
解题方法
2 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1) 的价电子排布图为:
的价电子排布图为:_________________________ ,基态磷原子的所有电子中有________ 种空间运动状态。
(2)Li、O、P三种元素的电负性由大到小的顺序是:________________________ 。
(3)无水硫酸铜为白色粉末溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有___________ 。
A.配位键 B.金属键 C.离子键 D.共价键
E.氢键 F.范德华力
(4)N和P是同主族元素,但是 分子中的键角大子
分子中的键角大子 分子中的键角,原因是:
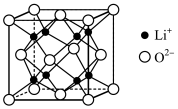
分子中的键角,原因是:___________________________________________ 。 为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为
为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为____________  (列出计算式即可),
(列出计算式即可), 和
和 的最短距离等于
的最短距离等于____________ nm(用含b的代数式表示)。
(1)
 的价电子排布图为:
的价电子排布图为:(2)Li、O、P三种元素的电负性由大到小的顺序是:
(3)无水硫酸铜为白色粉末溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有
A.配位键 B.金属键 C.离子键 D.共价键
E.氢键 F.范德华力
(4)N和P是同主族元素,但是
 分子中的键角大子
分子中的键角大子 分子中的键角,原因是:
分子中的键角,原因是: 为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为
为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为 (列出计算式即可),
(列出计算式即可), 和
和 的最短距离等于
的最短距离等于
您最近一年使用:0次
解题方法
3 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
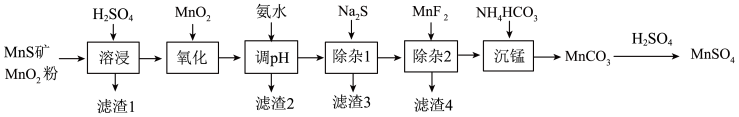
相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
(1)Fe2+的价电子排布式为_______ ,在元素周期表中Zn处于_______ 区。
(2)“滤渣1”含有S和_______ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(3)“氧化”中添加适量的MnO2的作用是_______ 。
(4)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(5)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______ 。
(6)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______ 。
(7)写出“沉锰”的离子方程式_______ 。
(8)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=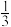 时,z=
时,z=_______ 。

相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)Fe2+的价电子排布式为
(2)“滤渣1”含有S和
(3)“氧化”中添加适量的MnO2的作用是
(4)“调pH”除铁和铝,溶液的pH范围应调节为
(5)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(6)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(7)写出“沉锰”的离子方程式
(8)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
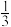 时,z=
时,z=
您最近一年使用:0次
2023-12-15更新
|
308次组卷
|
4卷引用:云南省腾冲市2022-2023学年高三上学期期中教育教学质量监测理科综合试卷
云南省腾冲市2022-2023学年高三上学期期中教育教学质量监测理科综合试卷江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题(已下线)T15-工业流程题(已下线)T15-工业流程题
4 . NCM是三元锂电池最重要的前驱体材料,一种以镍钴杂料(主要成分为 、
、 、
、 ,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
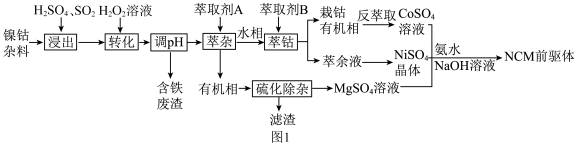
回答下列问题:
(1)基态钴原子核外未成对电子数与基态锰原子核外未成对电子数之比为___________ 。
(2)为提高“浸出”效率,可采取的措施有___________ (写出一条即可);“浸出”过程中 的作用是
的作用是___________ (用离子方程式表示)。
(3)常温下,若“转化”后的溶液中 浓度为
浓度为 ,在“调
,在“调 ”过程中,当
”过程中,当 调节到2.2时,开始出现
调节到2.2时,开始出现 沉淀,若要使
沉淀,若要使 完全沉淀,则调节溶液
完全沉淀,则调节溶液 最小为
最小为___________ [已知:当c(Fe3+)≤1×10-5mol/L时,认为 沉淀完全]
沉淀完全]
(4)有机萃取剂P204和P507对金属离子的萃取率与pH的关系如图2、图3所示。
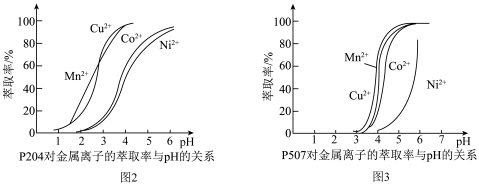
①萃取剂A是___________ (填“P204”或“P507”,下同),萃取剂B是___________ 。
②进行“萃钴”操作前,需对水相调pH至___________ (填标号),以达到最佳萃取 的效果。
的效果。
a.2.5 b.3.5 c.4.5 d.5.5
③萃取剂萃取 的原理为2HR(有机相)
的原理为2HR(有机相)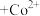 (水相)
(水相)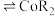 (有机相)
(有机相)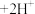 (水相),则反萃取操作中可向载钴有机相中加入
(水相),则反萃取操作中可向载钴有机相中加入___________ (填试剂名称)得到含 的溶液;一定条件下,萃取平衡时,溶液中
的溶液;一定条件下,萃取平衡时,溶液中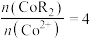 ,则
,则 的萃取率为
的萃取率为___________ 。
(5)一种NiAs晶体结构如图4所示。
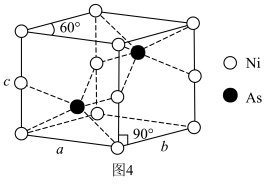
通过X射线光谱测算出该晶胞参数为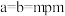 ,
,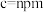 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为___________ (填含m、n和 的表达式)
的表达式) 。
。
 、
、 、
、 ,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
回答下列问题:
(1)基态钴原子核外未成对电子数与基态锰原子核外未成对电子数之比为
(2)为提高“浸出”效率,可采取的措施有
 的作用是
的作用是(3)常温下,若“转化”后的溶液中
 浓度为
浓度为 ,在“调
,在“调 ”过程中,当
”过程中,当 调节到2.2时,开始出现
调节到2.2时,开始出现 沉淀,若要使
沉淀,若要使 完全沉淀,则调节溶液
完全沉淀,则调节溶液 最小为
最小为 沉淀完全]
沉淀完全](4)有机萃取剂P204和P507对金属离子的萃取率与pH的关系如图2、图3所示。

①萃取剂A是
②进行“萃钴”操作前,需对水相调pH至
 的效果。
的效果。a.2.5 b.3.5 c.4.5 d.5.5
③萃取剂萃取
 的原理为2HR(有机相)
的原理为2HR(有机相)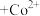 (水相)
(水相)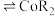 (有机相)
(有机相)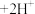 (水相),则反萃取操作中可向载钴有机相中加入
(水相),则反萃取操作中可向载钴有机相中加入 的溶液;一定条件下,萃取平衡时,溶液中
的溶液;一定条件下,萃取平衡时,溶液中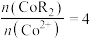 ,则
,则 的萃取率为
的萃取率为(5)一种NiAs晶体结构如图4所示。

通过X射线光谱测算出该晶胞参数为
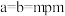 ,
,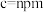 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为 的表达式)
的表达式) 。
。
您最近一年使用:0次
名校
解题方法
5 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据相关信息,回答下列问题:
(1)写出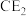 的电子式:
的电子式:_______ 。
(2)B元素基态原子中能量最高的电子,其电子云在空间有_______ 个取向。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为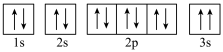 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_______ 。
(4)G元素位于_______ 区,该元素的核外电子排布式为_______ 。
(5)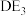 中心原子的杂化方式为
中心原子的杂化方式为_______ ,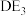 分子空间结构为
分子空间结构为_______ 。
(6)检验F元素的方法是_______ ,请用原子结构的知识解释产生此现象的原因_______ 。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子总数比s电子总数少1 |
 核外电子排布与Ne相同 核外电子排布与Ne相同 |
| 基态D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)写出
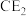 的电子式:
的电子式:(2)B元素基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)G元素位于
(5)
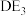 中心原子的杂化方式为
中心原子的杂化方式为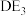 分子空间结构为
分子空间结构为(6)检验F元素的方法是
您最近一年使用:0次
解题方法
6 . 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰( 主要含ZnO,还含少量FeO、Al2O3、 CuO 及SiO2)为原料制取磷酸锌的工艺流程如图所示:
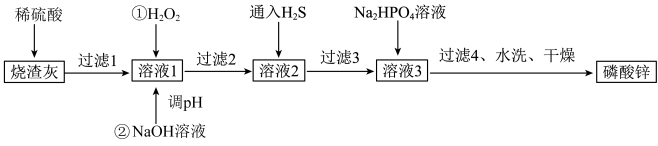
已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
回答下列问题:
(1)基态锌原子的价电子排布式为_____________ 。
(2)加入H2O2的作用是___________________________ 。
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是___________ 。
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:_________________ 。
(5)洗涤磷酸锌沉淀时应选用________ (填“冷水”或“热水”),洗涤沉淀的操作是________________ 。
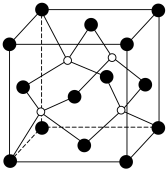
(6)图是碳化硅的晶胞结构,其晶体类型属于___________ 晶体。若碳化硅晶胞边长为a pm,阿伏加德罗常数的值为NA,则碳化硅晶体的密度为______________ g·cm-3 (列出计算式即可)。

已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4. | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)基态锌原子的价电子排布式为
(2)加入H2O2的作用是
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:
(5)洗涤磷酸锌沉淀时应选用
(6)图是碳化硅的晶胞结构,其晶体类型属于

您最近一年使用:0次
7 . 氮及其化合物在工农业生产中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一
Ⅰ.一定条件下,用 催化还原可消除NO污染。
催化还原可消除NO污染。
已知:
①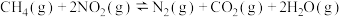
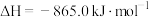
②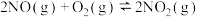
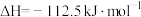
(1) 和
和 完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量,则
完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量,则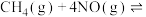
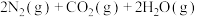

___________  ;一定温度下,往一体积不变的密闭容器中加入适量的
;一定温度下,往一体积不变的密闭容器中加入适量的 和NO,下列条件能判断该反应到达平衡状态的有
和NO,下列条件能判断该反应到达平衡状态的有___________ (填序号)。
A.混合气体的平均相对分子质量不变
B.
C.单位时间里有4n mol C—H断开同时有4n mol O—H断开
D.混合气体的压强不变
E.混合气体的密度不变
(2)将2mol NO(g)、1mol (g)和2mol He(g)通入反应器,在温度T、压强p条件下进行反应②和
(g)和2mol He(g)通入反应器,在温度T、压强p条件下进行反应②和 。平衡时,若
。平衡时,若 、
、 与
与 三者的物质的量相等,则NO转化率为
三者的物质的量相等,则NO转化率为___________ ,反应②平衡常数
___________ (用含p的代数式表示)。
Ⅱ.利用如图所示原理去除NO:
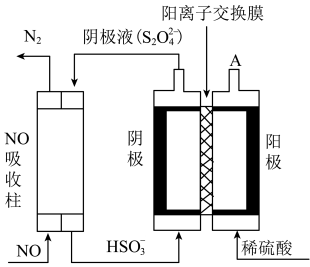
(3)基态N原子中,电子占据的最高能级为___________ 能级,该能级轨道的形状为___________ ;电解池中阴极反应式为___________ 。
(4)A口每产生224mL (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为___________ mol。
Ⅰ.一定条件下,用
 催化还原可消除NO污染。
催化还原可消除NO污染。已知:
①
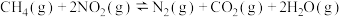
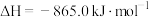
②
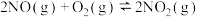
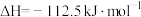
(1)
 和
和 完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量,则
完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量,则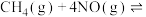
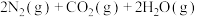

 ;一定温度下,往一体积不变的密闭容器中加入适量的
;一定温度下,往一体积不变的密闭容器中加入适量的 和NO,下列条件能判断该反应到达平衡状态的有
和NO,下列条件能判断该反应到达平衡状态的有A.混合气体的平均相对分子质量不变
B.

C.单位时间里有4n mol C—H断开同时有4n mol O—H断开
D.混合气体的压强不变
E.混合气体的密度不变
(2)将2mol NO(g)、1mol
 (g)和2mol He(g)通入反应器,在温度T、压强p条件下进行反应②和
(g)和2mol He(g)通入反应器,在温度T、压强p条件下进行反应②和 。平衡时,若
。平衡时,若 、
、 与
与 三者的物质的量相等,则NO转化率为
三者的物质的量相等,则NO转化率为
Ⅱ.利用如图所示原理去除NO:

(3)基态N原子中,电子占据的最高能级为
(4)A口每产生224mL
 (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为
您最近一年使用:0次
2023-09-20更新
|
335次组卷
|
2卷引用:云南大理市辖区2023-2024学年高三上学期毕业生区域性规模化统一检测理综化学试题
8 . 金属铜、铁在日常生活中应用广泛,根据下列说法回答下列问题。
(1) 的制备反应为
的制备反应为 。
。
上述氧化过程中, (II)
(II)_____ (答简化电子排布式)变为 III)
III)_____ (答外围电子排布图),基态 (III)电子占据
(III)电子占据_____ 个不同轨道。
(2)对上述反应式中的短周期元素按照电负性由小到大排序为_____
(3)配合物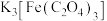 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为_____ 杂化。
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。
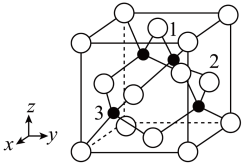
①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于_____ (填“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为( ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为_____ 、_____ 。
③已知该晶体的密度为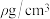 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____ pm(只写计算式)。
(1)
 的制备反应为
的制备反应为 。
。上述氧化过程中,
 (II)
(II) III)
III) (III)电子占据
(III)电子占据(2)对上述反应式中的短周期元素按照电负性由小到大排序为
(3)配合物
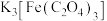 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。

①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(
 ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为③已知该晶体的密度为
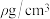 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
您最近一年使用:0次
名校
解题方法
9 . DF-31洲际弹道导弹是我国大国地位和国防实力的象征,其制作材料包含了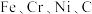 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1)基态铁原子的电子排布式为_______ , 具有较强的还原性,原因是
具有较强的还原性,原因是_______ 。
(2) 的第二电离能
的第二电离能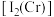 和
和 的第二电离能
的第二电离能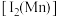 分别为
分别为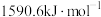 、
、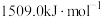 ,
, 的原因是
的原因是_______ ;过氧化铬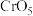 中
中 的化合价为
的化合价为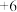 ,则分子中
,则分子中 键、π键的数目之比为
键、π键的数目之比为_______ 。
(3)下图中表示的碳原子能量最高的是_______(填字母)。
(4)超临界流体是物质介于气态和液态之间的新状态,目前应用最广泛的是超临界 。超临界
。超临界 流体是一种具有和水相似能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。
流体是一种具有和水相似能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。 中C原子的杂化方式为
中C原子的杂化方式为_______ ,分子中的化学键为_______ (填“极性键”或“非极性键”),分子属于_______ (填“极性”或“非极性”)分子。
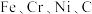 等多种元素。回答下列问题:
等多种元素。回答下列问题:(1)基态铁原子的电子排布式为
 具有较强的还原性,原因是
具有较强的还原性,原因是(2)
 的第二电离能
的第二电离能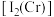 和
和 的第二电离能
的第二电离能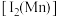 分别为
分别为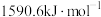 、
、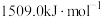 ,
, 的原因是
的原因是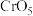 中
中 的化合价为
的化合价为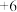 ,则分子中
,则分子中 键、π键的数目之比为
键、π键的数目之比为(3)下图中表示的碳原子能量最高的是_______(填字母)。
A. | B.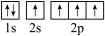 |
C.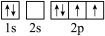 | D.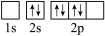 |
 。超临界
。超临界 流体是一种具有和水相似能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。
流体是一种具有和水相似能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。 中C原子的杂化方式为
中C原子的杂化方式为
您最近一年使用:0次
名校
解题方法
10 . 氯吡苯脲是一种常用的膨大剂,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。其结构简式如下:
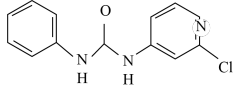
回答下列问题:
(1)基态氯原子价电子排布式为_______ 。
(2)氯吡苯脲的晶体中,氮原子的杂化轨道类型为_______ ,该物质易溶于水的原因是_______ 。
(3)氯吡苯脲晶体中,微粒间的作用力类型有_______ (填字母)。
A.离子键 B.极性键 C.非极性键 D.π键 E.氢键
(4)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。

反应过程中,每生成 氯吡苯脲,形成
氯吡苯脲,形成_______ 个 键、断裂
键、断裂_______ 个π键。
(5)膨大剂能在动物体内代谢,其产物较为复杂,其中有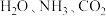 等,请用共价键理论解释
等,请用共价键理论解释 分子比
分子比 分子稳定的原因:
分子稳定的原因:_______ 。

回答下列问题:
(1)基态氯原子价电子排布式为
(2)氯吡苯脲的晶体中,氮原子的杂化轨道类型为
(3)氯吡苯脲晶体中,微粒间的作用力类型有
A.离子键 B.极性键 C.非极性键 D.π键 E.氢键
(4)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。

反应过程中,每生成
 氯吡苯脲,形成
氯吡苯脲,形成 键、断裂
键、断裂(5)膨大剂能在动物体内代谢,其产物较为复杂,其中有
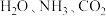 等,请用共价键理论解释
等,请用共价键理论解释 分子比
分子比 分子稳定的原因:
分子稳定的原因:
您最近一年使用:0次



