1 . N、P、As为第VA族元素,该族元素及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)基态As原子核外有______ 个未成对电子,N、P、As电负性由大到小的顺序为______ 。
(2)已知:4AsH3 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为______ ,已知As4为正四面体结构,则1molAs4中含______ molσ键。
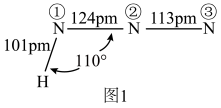
(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是______ 。叠氮酸的结构如图1所示,分子中②号N原子的杂化方式为_______ 。_______ ,该晶体的密度为______ g cm3。
cm3。
(1)基态As原子核外有
(2)已知:4AsH3
 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是
 cm3。
cm3。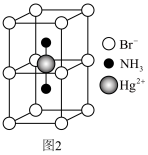
您最近一年使用:0次
2024-03-20更新
|
167次组卷
|
2卷引用:云南省文山州广南县第十中学校2023-2024学年高二下学期3月考试化学试题
名校
2 . 锌焙砂是锌精矿经焙烧后所得的产物,是褐色微颗粒状固体,其主要成分为 ,还含有
,还含有 、
、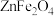 和少量
和少量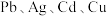 ,以锌焙砂为原料制备
,以锌焙砂为原料制备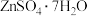 和黄铁矾的工艺流程如下:
和黄铁矾的工艺流程如下:
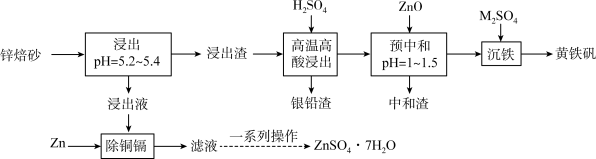
已知:①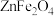 可以看成
可以看成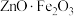 ,在高温高酸环境下才会溶解;
,在高温高酸环境下才会溶解;
② 下,
下, 和
和 开始沉淀和沉淀完全(
开始沉淀和沉淀完全(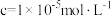 )时的
)时的 如下表:
如下表:
回答下列问题:
(1)基态 原子的简化电子排布式为
原子的简化电子排布式为_______ ,基态 原子价层电子轨道表示式为
原子价层电子轨道表示式为_______ ,基态 原子未成对电子数目为
原子未成对电子数目为_______ ,铜元素的焰色为绿色,该光谱属于_______ (填“发射”或“吸收”)光谱。
(2)欲提高 在5.2~5.4时的“浸出”速率,可采用的方法是
在5.2~5.4时的“浸出”速率,可采用的方法是_______ (写两种)。
(3)在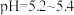 “浸出”时,锌焙砂中的铜转化为
“浸出”时,锌焙砂中的铜转化为 反应的离子方程式为
反应的离子方程式为_______ 。
(4) 时,浸出液中
时,浸出液中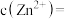
_______  。
。
(5)当有 、
、 或
或 存在时,调节含
存在时,调节含 溶液的
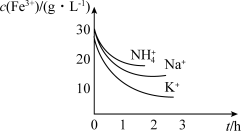
溶液的 ,即可生成黄铁矾。不同种类的阳离子“沉铁”效果如图,则工艺流程中,
,即可生成黄铁矾。不同种类的阳离子“沉铁”效果如图,则工艺流程中,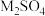 最好选用
最好选用_______ (填化学式)。
(6)获得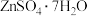 的一系列操作是
的一系列操作是_______ 、_______ 过滤、洗涤、干燥。
 ,还含有
,还含有 、
、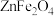 和少量
和少量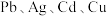 ,以锌焙砂为原料制备
,以锌焙砂为原料制备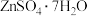 和黄铁矾的工艺流程如下:
和黄铁矾的工艺流程如下:
已知:①
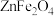 可以看成
可以看成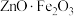 ,在高温高酸环境下才会溶解;
,在高温高酸环境下才会溶解;②
 下,
下, 和
和 开始沉淀和沉淀完全(
开始沉淀和沉淀完全(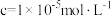 )时的
)时的 如下表:
如下表:| 金属离子 |  | |
| 开始沉淀 | 沉淀完全 | |
 | 6.2 | 8.2 |
 | 1.5 | 3.2 |
(1)基态
 原子的简化电子排布式为
原子的简化电子排布式为 原子价层电子轨道表示式为
原子价层电子轨道表示式为 原子未成对电子数目为
原子未成对电子数目为(2)欲提高
 在5.2~5.4时的“浸出”速率,可采用的方法是
在5.2~5.4时的“浸出”速率,可采用的方法是(3)在
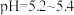 “浸出”时,锌焙砂中的铜转化为
“浸出”时,锌焙砂中的铜转化为 反应的离子方程式为
反应的离子方程式为(4)
 时,浸出液中
时,浸出液中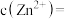
 。
。(5)当有
 、
、 或
或 存在时,调节含
存在时,调节含 溶液的
溶液的 ,即可生成黄铁矾。不同种类的阳离子“沉铁”效果如图,则工艺流程中,
,即可生成黄铁矾。不同种类的阳离子“沉铁”效果如图,则工艺流程中,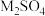 最好选用
最好选用
(6)获得
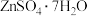 的一系列操作是
的一系列操作是
您最近一年使用:0次
2024-02-14更新
|
195次组卷
|
2卷引用:云南省昆明市云南师范大学实验中学2023-2024学年高二下学期3月月考化学试题
解题方法
3 . 皓矾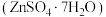 主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为
主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为 ,还含有少量
,还含有少量 以及
以及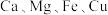 等的化合物)制备,制备流程图如图所示:
等的化合物)制备,制备流程图如图所示:

已知:常温下,金属离子开始沉淀和完全沉淀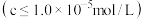 时的
时的 如下表所示:
如下表所示:
回答下列问题:
(1)写出基态铜原子的价层电子排布式_______ 。
(2)滤渣①的主要成分为_______ ;“浸取”工序中,能加快浸取效率的措施有_______ (任写一种作答)。
(3)“氧化”时该步骤离子方程式为_______ 。
(4)若“调 过滤”工序中,调节溶液
过滤”工序中,调节溶液 ,所得“滤渣②的主要成分为
,所得“滤渣②的主要成分为_______ ,氢氧化铁的溶度积常数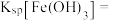
_______ 。
(5)“转化过滤”中加入锌粉的目的是_______ 。
(6)从滤液④获得皓矾晶体的具体操作为_______ 、_______ 、过滤、洗涤、干燥。
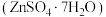 主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为
主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为 ,还含有少量
,还含有少量 以及
以及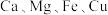 等的化合物)制备,制备流程图如图所示:
等的化合物)制备,制备流程图如图所示:
已知:常温下,金属离子开始沉淀和完全沉淀
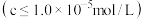 时的
时的 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |  |
开始沉淀时 | 1.9 | 6.4 | 4.7 | 7.0 | 9.1 |
沉淀完全时 | 3.4 | 8.4 | 6.7 | 9.0 | 11.1 |
(1)写出基态铜原子的价层电子排布式
(2)滤渣①的主要成分为
(3)“氧化”时该步骤离子方程式为
(4)若“调
 过滤”工序中,调节溶液
过滤”工序中,调节溶液 ,所得“滤渣②的主要成分为
,所得“滤渣②的主要成分为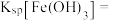
(5)“转化过滤”中加入锌粉的目的是
(6)从滤液④获得皓矾晶体的具体操作为
您最近一年使用:0次
解题方法
4 . a、b、c、d、e、f是原子序数依次增大的非0族元素,位于元素周期表的前四周期。a的一种核素无中子,b的s能级电子数与p能级的电子数之比为4:3,c与e同主族,未成对电子数为2,d在同周期元素中的原子半径最大,f在同周期元素中的未成对电子数最多。请回答下列问题:
(1)上述元素中,位于元素周期表p区的元素有________ (填元素符号),其中基态c原子中电子占据的最高能级的原子轨道形状是________ 。
(2)基态e原子的核外电子排布式为_______ ,其核外有____ 种不同空间运动状态的电子。
(3)b、c、d、e简单离子半径由大到小的顺序为_____ (用离子符号表示)。
(4)基态f原子的未成对电子数与成对电子数之比为______ 。
(1)上述元素中,位于元素周期表p区的元素有
(2)基态e原子的核外电子排布式为
(3)b、c、d、e简单离子半径由大到小的顺序为
(4)基态f原子的未成对电子数与成对电子数之比为
您最近一年使用:0次
5 . 元素周期表被认为是“科学共同的语言”,它的发现使化学学习和研究变得有规律可循。其简洁有序的背后,是众多科学家艰苦奋斗的结果。下图是元素周期表的一部分,请按要求回答下列问题:

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为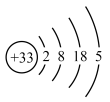 ,砷在周期表中的位置是
,砷在周期表中的位置是___________ 。我国“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。原子半径:Ga___________ As(填“>”或“<”)。
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途___________ 。
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为___________ (填化学式)。
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是___________ 。
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
(6)小赵同学在研究元素周期表时发现,碳元素有“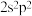 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是___________ 。

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为
 ,砷在周期表中的位置是
,砷在周期表中的位置是(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
| A.“类钫”在化合物中显+1价 |
| B.“类钫”单质具有强氧化性 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 |
| D.“类钫”单质能与冷水剧烈反应 |
(6)小赵同学在研究元素周期表时发现,碳元素有“
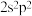 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是
您最近一年使用:0次
6 . 铜和三氧化二铁在工农业生产中用途广泛。用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
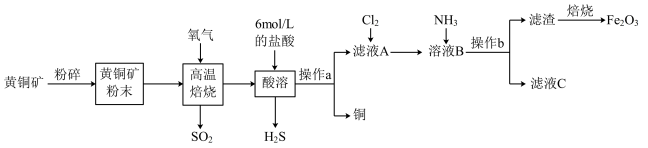
回答下列问题:
(1)铜的价电子排布式____________ 。
(2)高温焙烧时发生的反应是 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子____________ mol。
(3)向滤液A中通入 的目的是
的目的是________________________________________________ 。
(4)向溶液B中通入 后发生反应的离子方程式为
后发生反应的离子方程式为_____________________________________________ 。
(5)工业上用生物法处理 的原理为:(硫杆菌作催化剂)
的原理为:(硫杆菌作催化剂)
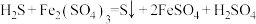
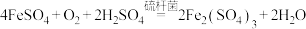
由图甲和图乙判断使用硫杆菌的最佳条件为___________________ 。若反应温度过高,反应速率下降,其原因是_______________________________________________ 。
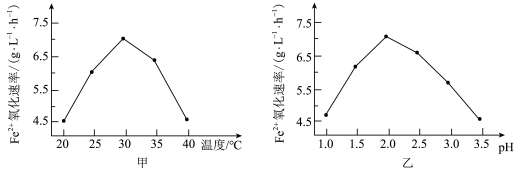
 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
回答下列问题:
(1)铜的价电子排布式
(2)高温焙烧时发生的反应是
 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子(3)向滤液A中通入
 的目的是
的目的是(4)向溶液B中通入
 后发生反应的离子方程式为
后发生反应的离子方程式为(5)工业上用生物法处理
 的原理为:(硫杆菌作催化剂)
的原理为:(硫杆菌作催化剂)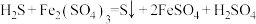
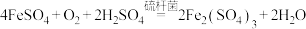
由图甲和图乙判断使用硫杆菌的最佳条件为

您最近一年使用:0次
解题方法
7 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1) 的价电子排布图为:
的价电子排布图为:_________________________ ,基态磷原子的所有电子中有________ 种空间运动状态。
(2)Li、O、P三种元素的电负性由大到小的顺序是:________________________ 。
(3)无水硫酸铜为白色粉末溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有___________ 。
A.配位键 B.金属键 C.离子键 D.共价键
E.氢键 F.范德华力
(4)N和P是同主族元素,但是 分子中的键角大子
分子中的键角大子 分子中的键角,原因是:
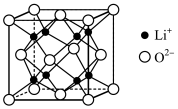
分子中的键角,原因是:___________________________________________ 。 为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为
为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为____________  (列出计算式即可),
(列出计算式即可), 和
和 的最短距离等于
的最短距离等于____________ nm(用含b的代数式表示)。
(1)
 的价电子排布图为:
的价电子排布图为:(2)Li、O、P三种元素的电负性由大到小的顺序是:
(3)无水硫酸铜为白色粉末溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有
A.配位键 B.金属键 C.离子键 D.共价键
E.氢键 F.范德华力
(4)N和P是同主族元素,但是
 分子中的键角大子
分子中的键角大子 分子中的键角,原因是:
分子中的键角,原因是: 为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为
为离子晶体,具有反萤石结构,晶胞如图所示。若晶胞参数为b nm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为 (列出计算式即可),
(列出计算式即可), 和
和 的最短距离等于
的最短距离等于
您最近一年使用:0次
解题方法
8 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
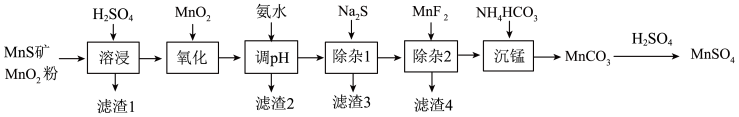
相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
(1)Fe2+的价电子排布式为_______ ,在元素周期表中Zn处于_______ 区。
(2)“滤渣1”含有S和_______ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(3)“氧化”中添加适量的MnO2的作用是_______ 。
(4)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(5)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______ 。
(6)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______ 。
(7)写出“沉锰”的离子方程式_______ 。
(8)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=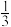 时,z=
时,z=_______ 。

相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)Fe2+的价电子排布式为
(2)“滤渣1”含有S和
(3)“氧化”中添加适量的MnO2的作用是
(4)“调pH”除铁和铝,溶液的pH范围应调节为
(5)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(6)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(7)写出“沉锰”的离子方程式
(8)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
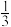 时,z=
时,z=
您最近一年使用:0次
2023-12-15更新
|
289次组卷
|
4卷引用:云南省腾冲市2022-2023学年高三上学期期中教育教学质量监测理科综合试卷
云南省腾冲市2022-2023学年高三上学期期中教育教学质量监测理科综合试卷江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题(已下线)T15-工业流程题(已下线)T15-工业流程题
9 . NCM是三元锂电池最重要的前驱体材料,一种以镍钴杂料(主要成分为 、
、 、
、 ,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
回答下列问题:
(1)基态钴原子核外未成对电子数与基态锰原子核外未成对电子数之比为___________ 。
(2)为提高“浸出”效率,可采取的措施有___________ (写出一条即可);“浸出”过程中 的作用是
的作用是___________ (用离子方程式表示)。
(3)常温下,若“转化”后的溶液中 浓度为
浓度为 ,在“调
,在“调 ”过程中,当
”过程中,当 调节到2.2时,开始出现
调节到2.2时,开始出现 沉淀,若要使
沉淀,若要使 完全沉淀,则调节溶液
完全沉淀,则调节溶液 最小为
最小为___________ [已知:当c(Fe3+)≤1×10-5mol/L时,认为 沉淀完全]
沉淀完全]
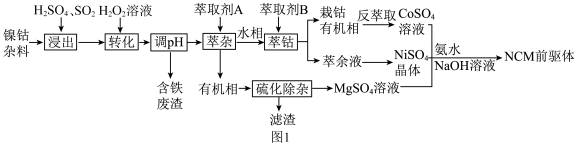
(4)有机萃取剂P204和P507对金属离子的萃取率与pH的关系如图2、图3所示。
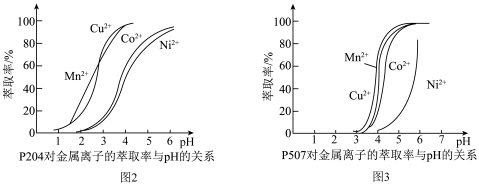
①萃取剂A是___________ (填“P204”或“P507”,下同),萃取剂B是___________ 。
②进行“萃钴”操作前,需对水相调pH至___________ (填标号),以达到最佳萃取 的效果。
的效果。
a.2.5 b.3.5 c.4.5 d.5.5
③萃取剂萃取 的原理为2HR(有机相)
的原理为2HR(有机相)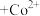 (水相)
(水相)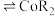 (有机相)
(有机相)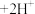 (水相),则反萃取操作中可向载钴有机相中加入
(水相),则反萃取操作中可向载钴有机相中加入___________ (填试剂名称)得到含 的溶液;一定条件下,萃取平衡时,溶液中
的溶液;一定条件下,萃取平衡时,溶液中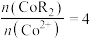 ,则
,则 的萃取率为
的萃取率为___________ 。
(5)一种NiAs晶体结构如图4所示。
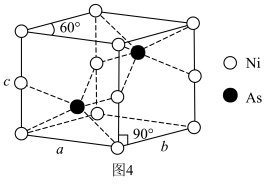
通过X射线光谱测算出该晶胞参数为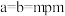 ,
,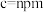 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为___________ (填含m、n和 的表达式)
的表达式) 。
。
 、
、 、
、 ,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
,还含有少量铁和铜的氧化物)为原料制备NCM前驱体的工艺流程如图1所示。
回答下列问题:
(1)基态钴原子核外未成对电子数与基态锰原子核外未成对电子数之比为
(2)为提高“浸出”效率,可采取的措施有
 的作用是
的作用是(3)常温下,若“转化”后的溶液中
 浓度为
浓度为 ,在“调
,在“调 ”过程中,当
”过程中,当 调节到2.2时,开始出现
调节到2.2时,开始出现 沉淀,若要使
沉淀,若要使 完全沉淀,则调节溶液
完全沉淀,则调节溶液 最小为
最小为 沉淀完全]
沉淀完全](4)有机萃取剂P204和P507对金属离子的萃取率与pH的关系如图2、图3所示。

①萃取剂A是
②进行“萃钴”操作前,需对水相调pH至
 的效果。
的效果。a.2.5 b.3.5 c.4.5 d.5.5
③萃取剂萃取
 的原理为2HR(有机相)
的原理为2HR(有机相)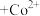 (水相)
(水相)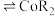 (有机相)
(有机相)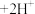 (水相),则反萃取操作中可向载钴有机相中加入
(水相),则反萃取操作中可向载钴有机相中加入 的溶液;一定条件下,萃取平衡时,溶液中
的溶液;一定条件下,萃取平衡时,溶液中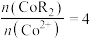 ,则
,则 的萃取率为
的萃取率为(5)一种NiAs晶体结构如图4所示。

通过X射线光谱测算出该晶胞参数为
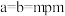 ,
,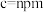 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为 的表达式)
的表达式) 。
。
您最近一年使用:0次
名校
解题方法
10 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据相关信息,回答下列问题:
(1)写出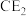 的电子式:
的电子式:_______ 。
(2)B元素基态原子中能量最高的电子,其电子云在空间有_______ 个取向。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_______ 。
(4)G元素位于_______ 区,该元素的核外电子排布式为_______ 。
(5)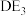 中心原子的杂化方式为
中心原子的杂化方式为_______ ,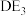 分子空间结构为
分子空间结构为_______ 。
(6)检验F元素的方法是_______ ,请用原子结构的知识解释产生此现象的原因_______ 。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子总数比s电子总数少1 |
 核外电子排布与Ne相同 核外电子排布与Ne相同 |
| 基态D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)写出
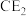 的电子式:
的电子式:(2)B元素基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)G元素位于
(5)
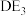 中心原子的杂化方式为
中心原子的杂化方式为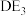 分子空间结构为
分子空间结构为(6)检验F元素的方法是
您最近一年使用:0次



