1 . X、Y、Z、Q、E五种元素中,X原子核外的M层只有两对成对电子,Y原子的核外L层电子数是K层的两倍,Z是地壳中含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大,F元素的基态原子的最外层有3个未成对电子,次外层有2个电子,请回答下列问题:
(1)X、Y、F的元素符号分别是_____ 、______ 、____ ,XZ2与YZ2的分子式分别为______ 和_____ 。
(2)Q的元素符号是___________ ,它位于第________ 周期,它的核外电子排布式为_____ ,在形成化合物时它最高的化合价为_______ 。
(3)E的单质与水反应的化学方程式为___________ 。
(1)X、Y、F的元素符号分别是
(2)Q的元素符号是
(3)E的单质与水反应的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 有A、B、C、D四种主族元素,原子序数依次增大,A元素原子 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:
(1)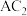 分子中含有
分子中含有___________ 个 键,属于
键,属于___________ (填“极性”或“非极性”)分子。
(2)B的简单气态氢化物的立体构型为___________ , 原子采用
原子采用___________ 杂化。
(3)写出 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:___________ 。
(4)C元素的电负性___________ (填“>”“<”或“=”)D元素的电负性,用一个化学方程式表示:___________ 。
 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:(1)
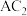 分子中含有
分子中含有 键,属于
键,属于(2)B的简单气态氢化物的立体构型为
 原子采用
原子采用(3)写出
 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:(4)C元素的电负性
您最近一年使用:0次
2023-05-02更新
|
122次组卷
|
3卷引用:云南省盐津县第二中学2018-2019学年高二上学期12月份考试化学试题
解题方法
3 . 同族金属A,B,C具有优良的导热、导电性能,若以I表示电离能,I1最低的是B,(I1+I2低的是A,(I1+I2+I3)最低的是C。
(1)同族元素D,E,F(均为非放射性副族元素)基态原子的价层电子组态符合同一个通式,在元素周期表中,位置在A、B、C所在族之前,请给出D、E、F的元素符号及价层电子组态的通式_______ 。
(2)元素A存在于动物的血蓝蛋白中,人对A元素代谢紊乱可导致Wilson病。
①A2+硫酸盐在碱性溶液中加入缩二脲HN(CONH2)2会得到特征的紫色物质,该物质为-2价的配位阴离子,具有对称中心和不通过A的二重旋转轴,无金属一金属键,请画出该阴离子的结构_______ (A必须写元素符号,下同)。
②通过A2+与过量的丁二酮肟形成二聚配合物,实现了A2+的平面正方形配位向A2+的四方锥形配位转化,请画出该配合物的结构_______ (丁二酮肟用N⌒N表示)。
(3)用B+的标准溶液滴定KCl和KSCN的中性溶液,得到电位滴定曲线,其拐点依次位于M、N、P处。
①请分别写出在M、N、P处达到滴定终点的离子反应方程式_______ 、_______ 、_______ 。
②在N处的物质是无支链的聚合物,请至少画出三个单元表示其结构_______ 。
(4)元素C的单质。与单一的无机酸不起作用,但可溶于王水。C与O2和F2作用制得化合物X,在X中C的质量分数为57.43%,X的结构与1962年N。Barlett开创性工作的产物极为相似,通过推演给出X的化学式_______ 。
(1)同族元素D,E,F(均为非放射性副族元素)基态原子的价层电子组态符合同一个通式,在元素周期表中,位置在A、B、C所在族之前,请给出D、E、F的元素符号及价层电子组态的通式
(2)元素A存在于动物的血蓝蛋白中,人对A元素代谢紊乱可导致Wilson病。
①A2+硫酸盐在碱性溶液中加入缩二脲HN(CONH2)2会得到特征的紫色物质,该物质为-2价的配位阴离子,具有对称中心和不通过A的二重旋转轴,无金属一金属键,请画出该阴离子的结构
②通过A2+与过量的丁二酮肟形成二聚配合物,实现了A2+的平面正方形配位向A2+的四方锥形配位转化,请画出该配合物的结构
(3)用B+的标准溶液滴定KCl和KSCN的中性溶液,得到电位滴定曲线,其拐点依次位于M、N、P处。
①请分别写出在M、N、P处达到滴定终点的离子反应方程式
②在N处的物质是无支链的聚合物,请至少画出三个单元表示其结构
(4)元素C的单质。与单一的无机酸不起作用,但可溶于王水。C与O2和F2作用制得化合物X,在X中C的质量分数为57.43%,X的结构与1962年N。Barlett开创性工作的产物极为相似,通过推演给出X的化学式
您最近一年使用:0次
名校
4 . 已知A、B、C、D是元素周期表中前20号的4种元素,原子序数和电子层数均依次增大。A元素的某种同位素原子核内无中子,B在地壳中含量最丰富,C是常见的非金属元素且最外层有1个未成对电子,D的+2价阳离子的核外电子排布与氩原子相同。
根据以上信息,回答问题:
(1)元素符号:A_______ ;B_______ ;C_______ ;D_______ 。
(2)B原子的电子式:_______ ,C离子的结构示意图:_______ 。
(3)C原子核外共有_______ 种不同运动状态的电子,D离子的最外层电子排布式是_______ 。
(4)A、B、C三种元素组成的化合物易分解,写出其方程式:___ 。
(5)C的单质与A、B、D三种元素组成物质反应的化学方程式为:___ ,生成物中可用于杀菌消毒的是_______ (写化学式)。
根据以上信息,回答问题:
(1)元素符号:A
(2)B原子的电子式:
(3)C原子核外共有
(4)A、B、C三种元素组成的化合物易分解,写出其方程式:
(5)C的单质与A、B、D三种元素组成物质反应的化学方程式为:
您最近一年使用:0次
名校
解题方法
5 . A元素在宇宙中含量最高,B元素的氢化物是有臭鸡蛋气味的气体,C元素常用于自来水消毒,是海水中除H、O外含量最高的元素,D元素的单质在空气中长期放置,容易生锈而变成绿色,该绿色锈溶于酸得到蓝色溶液。关于元素A、B、C、D,下列说法错误的是
A.含氧酸酸性: | B.电负性: |
C.第一电离能: | D.原子半径: |
您最近一年使用:0次
2022-04-06更新
|
41次组卷
|
2卷引用:湖北省十堰市房县第一中学2021届高三上学期12月月考化学试题
名校
解题方法
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的单质在空气中含量最大,Y原子的最外层电子数是次外层电子数的3倍,Z元素在短周期中金属性最强,元素W的原子半径在同周期最小。下列说法正确的是
| A.原子半径:r(W)>r(Z)>r(X) | B.第一电离能:I1(X)>I1(Y)>I1(Z) |
| C.X的气态氢化物的稳定性比Y的强 | D.Y和Z组成的化合物都只含离子键 |
您最近一年使用:0次
2021-09-22更新
|
454次组卷
|
3卷引用:江苏省沭阳县修远中学2022届高三上学期第一次阶段考试化学试题
12-13高三上·上海浦东新·期中
名校
解题方法
7 . 二十一世纪世界资源争夺的重点是海洋。海底有石油、可燃冰、石油气、矿砂、锰结核的资源,海水中除有渔业资源外,还有食盐、溴、碘等许多化学资源,所有资源中最丰富的是水资源。
(1)海水中质量分数最高的元素是氧,该元素的原子核外电子占据的轨道共有______ 个,有______ 个未成对电子。
(2)水的沸点为100℃,氟化氢的沸点为19.5℃,水与氟化氢比较,稳定性较强的是________ 。
(3)提取碘是将海带灼烧成灰,溶于水过滤,滤液中通入氯气,反应的离子方程式为_______________________________ ,再用四氯化碳将生成的单质碘________ (填写实验操作名称)出来,最后用_________ (填写实验操作名称)使碘和四氯化碳分离。
(4)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的最外层电子排布都可表示为______________ 。
(1)海水中质量分数最高的元素是氧,该元素的原子核外电子占据的轨道共有
(2)水的沸点为100℃,氟化氢的沸点为19.5℃,水与氟化氢比较,稳定性较强的是
(3)提取碘是将海带灼烧成灰,溶于水过滤,滤液中通入氯气,反应的离子方程式为
(4)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的最外层电子排布都可表示为
您最近一年使用:0次
解题方法
8 . 煅烧黄铁矿(主要成分为FeS2)所得的矿渣中含Fe2O3、SiO2、Al2O3、MgO等.用该矿渣可制备铁红(Fe2O3).完成下列填空:
(1)煅烧黄铁矿的化学方程式____ ,反应过程中被氧化的元素____ .
(2)矿渣中属于两性氧化物的是___ ,写出Fe2O3与稀硫酸反应的离子方程式__ .
(3)Al(OH)3的碱性比Mg(OH)2的碱性___ (选填“强”或“弱”);铝原子最外层电子排布式为____ .
(4)SiO2的熔点___ Fe2O3的熔点(填“大于”或“小于”),原因是__ .
(5)已知矿渣质量为w kg,若铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来矿渣中铁元素质量分数为______ (用表达式表示).
(1)煅烧黄铁矿的化学方程式
(2)矿渣中属于两性氧化物的是
(3)Al(OH)3的碱性比Mg(OH)2的碱性
(4)SiO2的熔点
(5)已知矿渣质量为w kg,若铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来矿渣中铁元素质量分数为
您最近一年使用:0次
名校
解题方法
9 . R、T、W、X、Y、Z都是短周期元素,且W、X、Y、Z的核电荷数依次增大。下表列出它们的性质和结构:
(1)Z原子的外围电子轨道表达式为___________ ,T、X、Z的第一电离能由大到小的顺序为___________ (用化学符号填空)。
(2)常温下,RW3是一种刺激性气味、易液化的气体。RW3极易溶于水的主要原因是___________ (至少答两点)。
(3)在浓的QCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为QCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为___________ ,1mol的QCl3·6H2O的绿色晶体溶于水再加入足量AgNO3溶液,得到的沉淀的物质的量为___________ 。
(4)分析R、T、X、Z简单氢化物的沸点高低并解释原因___________
| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 宇宙中含量最多的元素 |
| X | 核外s能级上的电子总数与P能级上的电子总数相等 |
| Z | 原子核外P能级上的电子总数比s能级上的电子总数多2 |
| Q | 有“生物金属”之称,Q4+和氩原子的核外电子排布相同 |
(1)Z原子的外围电子轨道表达式为
(2)常温下,RW3是一种刺激性气味、易液化的气体。RW3极易溶于水的主要原因是
(3)在浓的QCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为QCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为
(4)分析R、T、X、Z简单氢化物的沸点高低并解释原因
您最近一年使用:0次
2021-10-08更新
|
180次组卷
|
3卷引用:2020年天津卷化学高考真题变式题1-12
10 . 某金属M的氧化物A是易挥发的液体,有毒,微溶于水。在氯化氢气氛中蒸发A的盐酸溶液(含1.000 g的A)得到1.584 g晶体MCl3·3H2O。
(1)假定转化反应按化学计量比进行,通过计算确定A的化学式________ ,并写出金属M的价电子构型________ 。从精炼镍的阳极泥提取M的步骤为:
①用王水处理溶解Pt、Pd和Au;
②固体不溶物与碳酸铅共热,然后用稀硝酸处理除去可溶物B;
③剩余固体不溶物与硫酸氢钠共熔,用水浸取除去可溶物C;
④留下的固体不溶物与过氧化钠共熔,用水浸取,过滤。滤液中含有M的盐D,D为Na2SO4型电解质,无水D中氧含量为30.32%;
⑤往D溶液中通入Cl2,加热,收集40- 50 °C的馏分,得到A.A收集在盐酸中,加热得到E的溶液,E中Cl含量为67.14%;
⑥溶液E中加入适量NH4Cl溶液得到沉淀F,F中Cl含量为57.81%。F在氢气中燃烧即得到金属M。
已知φ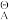 (NO
(NO /NO)= 0.957V,φ
/NO)= 0.957V,φ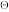 ([PtCl4]2-/Pt)= 0.755V,φ
([PtCl4]2-/Pt)= 0.755V,φ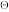 (PtCl6]2-/[PtCl4]2-= 0.680V,所有离子活度系数为1.00。
(PtCl6]2-/[PtCl4]2-= 0.680V,所有离子活度系数为1.00。
(2)写出步骤(1)中除去Pt的化学反应方程式________ ,计算该反应在298 K下的K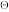
________ 。
(3)写出步骤(2)中除去银的化学反应方程式________ 。
(4)D、E、F中均只有1个金属原子,试通过计算确定D、E、F的化学式________ 、________ 、________ 。
(1)假定转化反应按化学计量比进行,通过计算确定A的化学式
①用王水处理溶解Pt、Pd和Au;
②固体不溶物与碳酸铅共热,然后用稀硝酸处理除去可溶物B;
③剩余固体不溶物与硫酸氢钠共熔,用水浸取除去可溶物C;
④留下的固体不溶物与过氧化钠共熔,用水浸取,过滤。滤液中含有M的盐D,D为Na2SO4型电解质,无水D中氧含量为30.32%;
⑤往D溶液中通入Cl2,加热,收集40- 50 °C的馏分,得到A.A收集在盐酸中,加热得到E的溶液,E中Cl含量为67.14%;
⑥溶液E中加入适量NH4Cl溶液得到沉淀F,F中Cl含量为57.81%。F在氢气中燃烧即得到金属M。
已知φ
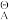 (NO
(NO /NO)= 0.957V,φ
/NO)= 0.957V,φ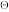 ([PtCl4]2-/Pt)= 0.755V,φ
([PtCl4]2-/Pt)= 0.755V,φ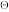 (PtCl6]2-/[PtCl4]2-= 0.680V,所有离子活度系数为1.00。
(PtCl6]2-/[PtCl4]2-= 0.680V,所有离子活度系数为1.00。(2)写出步骤(1)中除去Pt的化学反应方程式
(3)写出步骤(2)中除去银的化学反应方程式
(4)D、E、F中均只有1个金属原子,试通过计算确定D、E、F的化学式
您最近一年使用:0次



