解题方法
1 . 云南省曲靖市物华天宝,资源丰富,煤炭、磷、铅、锌、锑等资源储量位居全省前列,会泽县“斑铜”技艺更是闻名全国。2021年12月,中国有色金属工业协会授予曲靖市“绿色晶硅光伏之都”称号。
(1)晶体硅中Si原子的杂化方式是____ ,基态Zn原子核外电子排布式为____ ,基态Cu原子核外有____ 种能量不同的电子。
(2)磷化亚铜(Cu3P)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化亚铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为____ ;Si、P、S的第一电离能(I1)由大到小的顺序为____ 。
(3)一种铜金合金具有储氢功能。其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为____ 。该储氢材料储氢时,氢分子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图1),该晶体储氢后的化学式为____ 。
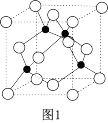
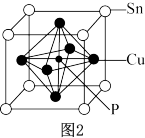
(4)磷青铜晶体的晶胞结构如图2所示,该晶体中P原子位于由铜原子形成的____ 的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为____ nm(用含NA的代数式表示)。
(1)晶体硅中Si原子的杂化方式是
(2)磷化亚铜(Cu3P)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化亚铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为
(3)一种铜金合金具有储氢功能。其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为

(4)磷青铜晶体的晶胞结构如图2所示,该晶体中P原子位于由铜原子形成的

您最近一年使用:0次
20-21高三上·江苏南通·阶段练习
名校
2 . 钴的一种化合物的晶胞结构如图所示,下列说法正确的是


| A.元素钛在元素周期表中的位置为第四周期V B族 |
| B.Co2+的基态核外电子排布式为1s2 2s2 2p63s2 3p63d54s2 |
| C.与Co2+距离最近的Ti4+有4个 |
| D.该化合物的化学式为CoTiO3 |
您最近一年使用:0次
2022-05-27更新
|
739次组卷
|
21卷引用:云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题
云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题吉林省长春市第二实验中学2021-2022学年高二下学期开学考试化学试题湖南省衡阳市田家炳实验中学2021-2022学年高二下学期3月质量检测化学试题重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题北京市第二十二中学 2021-2022 学年高二下学期期中考试化学试题黑龙江省大庆市大庆中学2021-2022学年高二下学期期中考试化学试题广东省江门市鹤山区鹤华中学2021-2022学年高二下学期期中考试化学试题专题3 微粒间作用力与物质性质 第二单元 离子键 离子晶体山西省临汾市尧都区山西师范大学实验中学2021-2022学年高二下学期第一次月考化学考试试题湖北省武汉市钢城第四中学2021-2022学年高二下学期期中考试化学试题黑龙江省佳木斯市第八中学2021-2022学年高二下学期期中考试化学试题四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题天津市第四十七中学2022-2023学年高三上学期期中考试化学试题(已下线)江苏省如皋市2021届高三上学期第三次月考化学试题江苏省江阴市第一中学2021届高三12月份阶段性检测化学试题江苏省南京市第十三中学2021届高三上学期教学质量调研(三)化学试题福建省泉州科技中学2020-2021学年高二下学期第一次月考化学试题山东省济宁市兖州区2020-2021学年高二下学期期中考试化学试题3.2.1离子键 离子晶体 课后内蒙古呼伦贝尔市海拉尔第二中学2023-2024学年高二上学期期末考试化学试题(已下线)热点06 物质的聚集状态与晶体的常识
解题方法
3 . 胆矾化学式为CuSO4·5H2O。实验证明CuSO4·5H2O中有4个水分子为配位水分子,其结构示意图如下:回答下列问题:
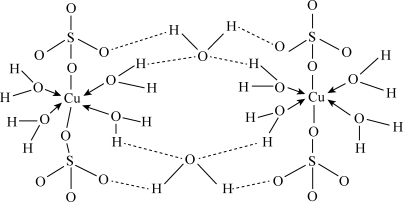
(1)基态铜原子的价层电子排布式为_______ ,位于周期表中第_______ 周期_______ 族。
(2)胆矾中S原子的杂化方式是_______ ,H、O、S中,第一电离能最大的元素是_______ (填元素符号)
(3)胆矾中存在的化学键有配位键、_______ 。
(4)含硫化合物SOCl2的VSEPR模型是_______ ,试分析该分子中键角∠Cl-S-O大于∠Cl-S-Cl的原因是_______ 。
(5)立方铜晶胞中铜原子的配位数为12,则每个晶胞中有_______ 个铜原子,铜原子的半径为rcm,则铜晶体的密度为_______ g·cm-3(阿伏加德罗常数值用NA表示)。

(1)基态铜原子的价层电子排布式为
(2)胆矾中S原子的杂化方式是
(3)胆矾中存在的化学键有配位键、
(4)含硫化合物SOCl2的VSEPR模型是
(5)立方铜晶胞中铜原子的配位数为12,则每个晶胞中有
您最近一年使用:0次
解题方法
4 . 硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子的价电子排布式为_______ ,晶体硅和碳化硅熔点较高的是_______ (填化学式)。
(2)硅和卤素单质反应可以得到 ,
, 的熔沸点如下表:
的熔沸点如下表:
①0℃时, 、
、 、
、 、
、 呈气态是
呈气态是_______ (填化学式),沸点依次升高的原因是_______ ,气态 分子中心原子的杂化类型为
分子中心原子的杂化类型为_______ 。
② 与N-甲基咪唑(
与N-甲基咪唑( )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:

M2+中硅原子的杂化轨道类型为_______ (填标号:①sp3、②sp3d、③sp3d2)。H、C、N的电负性由大到小的顺序为_______ 。
(3)下图是Mg、 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
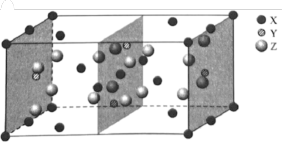
①已知化合物中 和
和 的原子个数比为1:4,图中Y表示
的原子个数比为1:4,图中Y表示_______ 原子(填元素符号),该化合物的化学式为_______ 。
②已知该晶胞的晶胞参数分别为a pm、b pm、c pm, ,则该晶体的密度
,则该晶体的密度
_______  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
(1)基态硅原子的价电子排布式为
(2)硅和卤素单质反应可以得到
 ,
, 的熔沸点如下表:
的熔沸点如下表: |  |  |  | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
 、
、 、
、 、
、 呈气态是
呈气态是 分子中心原子的杂化类型为
分子中心原子的杂化类型为②
 与N-甲基咪唑(
与N-甲基咪唑( )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
M2+中硅原子的杂化轨道类型为
(3)下图是Mg、
 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
①已知化合物中
 和
和 的原子个数比为1:4,图中Y表示
的原子个数比为1:4,图中Y表示②已知该晶胞的晶胞参数分别为a pm、b pm、c pm,
 ,则该晶体的密度
,则该晶体的密度
 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
5 . 火药制备是我国古代闻名世界的化学工艺,原理为2KNO3+S+3C=K2S+N2↑+3CO2↑。下列表示反应中相关微粒的化学用语正确的是
| A.K+的核外电子排布式: 1s22s22p6 | B.S的价电子排布式:3p4 |
| C.CO2的结构式为: O=C=O | D.K2S 的电子式: |
您最近一年使用:0次
2022-05-08更新
|
141次组卷
|
2卷引用:云南省部分重点中学2022-2023学年高三上学期月考化学试题
名校
6 . X、Y、Z、W、R为原子序数依次增大的短周期主族元素。X、Z原子中分别有1个、7个运动状态完全不同的电子,Y原子中各能级电子数相等,W原子最外层电子数是内层的3倍,R的原子半径是该周期主族元素中最大的。下列说法正确的是
| A.气态氢化物热稳定性:Y>Z>W |
| B.简单离子半径:r(W)>r(R) |
| C.第一电离能:I1(W)>I1(Z)>I1(Y) |
| D.X、Z、W形成的化合物一定不含离子键 |
您最近一年使用:0次
2022-05-07更新
|
627次组卷
|
9卷引用:云南省部分重点中学2022-2023学年高三上学期月考化学试题
名校
解题方法
7 . 下 列电子排布式中,原子处于激发状态的是
| A.1s22s22p5 | B.1s22s22p43s2 |
| C.1s22s22p63s23p63d54s2 | D.1s22s22p63s23p63d34s2 |
您最近一年使用:0次
2022-05-05更新
|
371次组卷
|
6卷引用:云南省景东彝族自治县第一中学2021-2022学年高二下学期3月份考试化学试题
8 . 硅、磷、硫、氯都是第三周期的非金属元素,它们在工农业生产中都有重要的用途。回答下列问题:
(1)H3PO4为三元中强酸:
①基态磷原子的价电子轨道表示式为_______ 。
②H、P、O的第一电离能由大到小的顺序为_______ (填元素符号)。
③ 的空间结构是
的空间结构是_______ 。
④H2O和PH3相比,沸点较高的是_______ 。
(2)三硫化四磷是黄绿色针状结晶,其结构如图甲所示。

①三硫化四磷分子中P原子采取_______ 杂化。
②电负性:S_______ (填“>”、“<”或“=”)P。
③两种含磷化合物的熔点:PCl3_______ (填“>”、“<”或“=”)PCl5。
(3)晶体硅的晶胞如图乙所示,则晶体硅中Si原子与Si-Si键数目之比为_______ ;设该晶胞的边长为a nm,晶体硅的摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则该晶体的密度为_______ (用含a、M、NA的代数式表示)g/cm3。
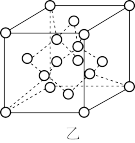
(1)H3PO4为三元中强酸:
①基态磷原子的价电子轨道表示式为
②H、P、O的第一电离能由大到小的顺序为
③
 的空间结构是
的空间结构是④H2O和PH3相比,沸点较高的是
(2)三硫化四磷是黄绿色针状结晶,其结构如图甲所示。

①三硫化四磷分子中P原子采取
②电负性:S
③两种含磷化合物的熔点:PCl3
(3)晶体硅的晶胞如图乙所示,则晶体硅中Si原子与Si-Si键数目之比为

您最近一年使用:0次
2022-05-02更新
|
93次组卷
|
2卷引用:云南省名校联盟2021-2022学年高二下学期期中考试化学(B1)试题
名校
解题方法
9 . 在前四周期元素中,基态原子有3个未成对电子的元素种数为
| A.3 | B.4 | C.5 | D.6 |
您最近一年使用:0次
2022-05-02更新
|
158次组卷
|
4卷引用:云南省名校联盟2021-2022学年高二下学期期中考试化学(B1)试题
10 . 某元素基态原子的核外有三个能层,能量最高的能层上有7个电子,该原子核内的质子数为
| A.7 | B.9 | C.15 | D.17 |
您最近一年使用:0次



