名校
1 . Ⅰ.双氰胺结构简式如图。
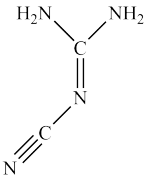
(1)双氰胺的晶体类型为_______ 。
(2)双氰胺所含元素中,_______ (填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_______ 。
Ⅱ.硼的最简单氢化物——乙硼烷球棍模型如下图,由它制取硼氢化锂的反应为2LiH+B2H6=2LiBH4
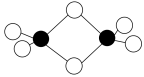
(4)乙硼烷分子中硼原子的杂化轨道类型为_______ 。
(5)BH 为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为_______ (填序号)。
A.离子键 B.金属键 C.氢键 D.配位键 E.极性键 F.非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为_______ (填元素符号)。
(7)碳的最简单氢化物是CH4,而硼的最简单氢化物不是BH3,其原因为_______ 。

(1)双氰胺的晶体类型为
(2)双氰胺所含元素中,
(3)双氰胺分子中σ键和π键数目之比为
Ⅱ.硼的最简单氢化物——乙硼烷球棍模型如下图,由它制取硼氢化锂的反应为2LiH+B2H6=2LiBH4

(4)乙硼烷分子中硼原子的杂化轨道类型为
(5)BH
 为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为A.离子键 B.金属键 C.氢键 D.配位键 E.极性键 F.非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为
(7)碳的最简单氢化物是CH4,而硼的最简单氢化物不是BH3,其原因为
您最近一年使用:0次
名校
2 . 某元素原子序数为35,则
(1)此元素原子的电子总数是_______ ,有_______ 个未成对电子。
(2)有_______ 个电子层,有_______ 个原子轨道排布了电子。
(3)它的电子排布式为_______ 。
(4)该元素位于周期表第_______ 周期_______ 族。
(1)此元素原子的电子总数是
(2)有
(3)它的电子排布式为
(4)该元素位于周期表第
您最近一年使用:0次
名校
3 . 光气( )是一种重要的有机中间体。利用反应可
)是一种重要的有机中间体。利用反应可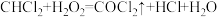 用于制备光气。下列有关叙述正确的是
用于制备光气。下列有关叙述正确的是
 )是一种重要的有机中间体。利用反应可
)是一种重要的有机中间体。利用反应可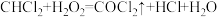 用于制备光气。下列有关叙述正确的是
用于制备光气。下列有关叙述正确的是A.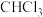 为非极性分子 为非极性分子 | B. 的电子式为 的电子式为 |
C. 、 、 分子间均能形成氢键 分子间均能形成氢键 | D.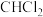 中电负性最小的元素是Cl 中电负性最小的元素是Cl |
您最近一年使用:0次
2022-08-17更新
|
106次组卷
|
3卷引用:云南省昭通市第一中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
4 . 原子序数依次增大的四种元素A、B、C、D分别处于第1~4周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是____ (填元素符号,下同),第一电离能最小的是____ 。
(2)C所在的主族元素气态氢化物中,沸点最低的是____ (填化学式)。
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为____ 。

(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是____ (填选项序号)。

①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如图:
D单质 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 蓝色溶液
蓝色溶液 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:____ 。
(1)这四种元素中电负性最大的是
(2)C所在的主族元素气态氢化物中,沸点最低的是
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为

(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是

①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如图:
D单质
 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 蓝色溶液
蓝色溶液 黑色沉淀
黑色沉淀请书写第⑤步反应的离子方程式:
您最近一年使用:0次
名校
解题方法
5 . 硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题:
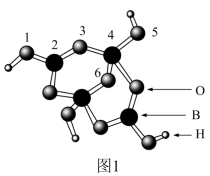
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为_______ ;4号硼原子参与形成的化学键有_______ ;m=_______ (填数字)。
(2)BN中B的化合价为_______ ,请解释原因:_______ 。
(3)BF3和过量NaF作用可生成NaBF4,BF 的立体构型为
的立体构型为_______ ;NaBF4的电子式为_______ 。
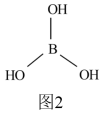
(4)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:_______
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为

(2)BN中B的化合价为
(3)BF3和过量NaF作用可生成NaBF4,BF
 的立体构型为
的立体构型为(4)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:

您最近一年使用:0次
11-12高二上·福建厦门·期中
名校
6 . 下列各组P、Q原子中,彼此的化学性质一定相似的是
| A.P原子:最外电子层1s2;Q原子:最外电子层2s2 |
| B.P原子:M电子层上有2个电子;Q原子:N电子层上有2个电子 |
| C.P原子:2p能级上有1个未成对电子;Q原子:3p能级上也有1个未成对电子 |
| D.P原子:最外电子层L层上只有一个空轨道;Q原子:最外电子层M层上也只有一个空轨道 |
您最近一年使用:0次
2022-08-16更新
|
272次组卷
|
11卷引用:云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题
云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2014高考化学苏教版总复习 专题12物质结构与性质练习卷辽宁省六校协作体2016-2017学年高二下学期期中考试化学试题福建省宁德市六校2018-2019学年高二第二学期期中联合考试化学试题2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第1课时 基态原子的核外电子排布重庆市渝高中学校2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
7 . 有X、Y两种主族元素,下列有关预测不正确的是
| A.若X的I1小于Y的I1,则X的金属性不一定比Y的强 |
| B.若X、Y的电负性之和小于3,则X、Y均为金属元素 |
| C.若X、Y的电负性之差为2.2,则X、Y形成的化合物很可能是离子化合物 |
| D.若X、Y的最高价氧化物对应的水化物的化学式分别为HXO3、H3YO4,则X、Y均位于元素周期表的p区 |
您最近一年使用:0次
名校
解题方法
8 . 雄黄(As4S4)、雌黄(As2S3)均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:
(1)基态硫原子核外电子的空间运动状态有____ 种;其核外电子运动最高能级的电子云轮廓图的形状为____ 。
(2)基态砷原子的价层电子的轨道表示式为____ 。
(3)S和As比较,电负性较大的是____ ,其判断理由是____ 。
(4)As2S3、As4S4分子中各原子最外层均满足8电子结构,且As、S原子的化学环境均分别只有一种,分别写出As2S3、As4S4的结构式_____ 、____ 。
(1)基态硫原子核外电子的空间运动状态有
(2)基态砷原子的价层电子的轨道表示式为
(3)S和As比较,电负性较大的是
(4)As2S3、As4S4分子中各原子最外层均满足8电子结构,且As、S原子的化学环境均分别只有一种,分别写出As2S3、As4S4的结构式
您最近一年使用:0次
解题方法
9 . 短周期元素A、B、C、D、E的原子序数依次增大,其最外层电子数与原子半径的大小关系如图所示,请按要求回答下列问题:
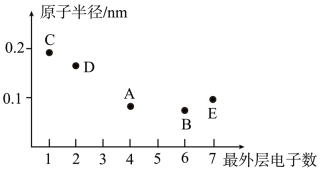
(1)基态E原子中有______ 种不同能量的电子,其中能量最高的电子所占据能级的电子云轮廓图呈______ 形。
(2)五种元素中,非金属元素第一电离能最小的是______ (填元素符号),非金属元素形成的最高价含氧酸的酸性最强的是______ (填化学式)。
(3)五种元素中,金属元素的金属性最强的是______ (填元素符号),设计一个简单的实验,证明金属元素金属性的强弱,简述实验步骤和现象:______ 。
(4)欲鉴定月球上是否有A元素的存在,可以通过______ 的方法。

(1)基态E原子中有
(2)五种元素中,非金属元素第一电离能最小的是
(3)五种元素中,金属元素的金属性最强的是
(4)欲鉴定月球上是否有A元素的存在,可以通过
您最近一年使用:0次
解题方法
10 . 下列说法中,正确的是
| A.不同能层的s轨道大小、形状都相同 |
| B.最外层电子数为2的元素一定位于s区 |
| C.电离能越大的元素,电负性也越大 |
D.不同状态下的碳原子的能量: |
您最近一年使用:0次



