名校
1 . 现有三种元素的基态原子的电子排布式如下:①1s22s22p4;②1s22s22p63s23p4;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能;③>②>① | B.原子半径;②>①>③ |
| C.电负性:②>①>③ | D.最高正化合价:③>②=① |
您最近一年使用:0次
2022-04-27更新
|
264次组卷
|
7卷引用:云南省楚雄州2021-2022学年高二下学期期末考试化学试题
名校
解题方法
2 . CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:2Cu2++ 2C1-+SO2+2H2O 2CuCl↓+4H++
2CuCl↓+4H++ ,2CuCl2+SnCl2 =2CuCl↓+SnCl4
,2CuCl2+SnCl2 =2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2CH2-NH2)可形成配离子:
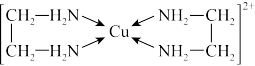
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_______ , H、 N、O三种元素的电负性由大到小的顺序是_______ 。
(2)SO2分子的空间构型为_______ ,与SnCl4互为等电子体的一种离子的符号为_______ 。
(3)乙二胺分子中氮原子轨道的杂化类型为_______ , 乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是_______ 。
(4)②中所形成的配离子中不含有的化学键类型有_______ (填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如图所示。若晶胞边长为a cm,阿伏加德罗常数为NA mol-1,则该晶体的密度_______ g·cm-3。

已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:2Cu2++ 2C1-+SO2+2H2O
 2CuCl↓+4H++
2CuCl↓+4H++ ,2CuCl2+SnCl2 =2CuCl↓+SnCl4
,2CuCl2+SnCl2 =2CuCl↓+SnCl4②CuCl2溶液与乙二胺(H2N-CH2CH2-NH2)可形成配离子:

请回答下列问题:
(1)基态Cu原子的核外电子排布式为
(2)SO2分子的空间构型为
(3)乙二胺分子中氮原子轨道的杂化类型为
(4)②中所形成的配离子中不含有的化学键类型有
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如图所示。若晶胞边长为a cm,阿伏加德罗常数为NA mol-1,则该晶体的密度

您最近一年使用:0次
解题方法
3 . 丙二烯磷酸加氢生成顺丙烯磷酸是磷霉素合成的关键步骤,反应原理是:

回答下列问题:
(1)Pd的原子序数是46,基态Pd原子轨道中不存在单电子,基态Pd原子的价电子排布式是_________ .
(2)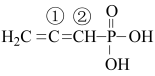 中电负性最大的元素是
中电负性最大的元素是_________ (填元素符号):①号碳原子的杂化方式是_____________ ,②号碳原子的价层电子对数为____________ .
(3) 有2种八面体结构:
有2种八面体结构:
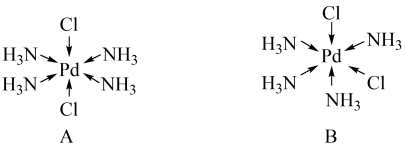
①有极性的结构是________ (填标号).
②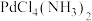 中
中 中
中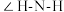 的键角
的键角_________ (填“<”、“>”或“=") 中
中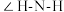 的键角.
的键角.
(4) 能与水混溶,却不溶于
能与水混溶,却不溶于 ,原因是
,原因是______________________ .
(5)Pd的晶胞俯视图如下所示:

已知1个晶胞中含4个Pd原子,其中3个Pd原子的坐标是 ,
, ,
, 则晶胞中每个Pd原子周围距离相等且最近的Pd原子有
则晶胞中每个Pd原子周围距离相等且最近的Pd原子有__________ 个;某铜钯合金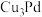 可看作上述Pd晶胞中
可看作上述Pd晶胞中_______ 位置的Pd原子被Cu原子替代.

回答下列问题:
(1)Pd的原子序数是46,基态Pd原子轨道中不存在单电子,基态Pd原子的价电子排布式是
(2)
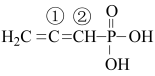 中电负性最大的元素是
中电负性最大的元素是(3)
 有2种八面体结构:
有2种八面体结构: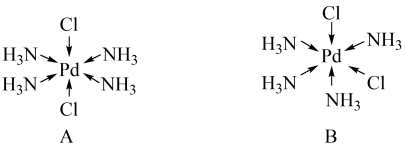
①有极性的结构是
②
 中
中 中
中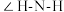 的键角
的键角 中
中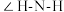 的键角.
的键角.(4)
 能与水混溶,却不溶于
能与水混溶,却不溶于 ,原因是
,原因是(5)Pd的晶胞俯视图如下所示:

已知1个晶胞中含4个Pd原子,其中3个Pd原子的坐标是
 ,
, ,
, 则晶胞中每个Pd原子周围距离相等且最近的Pd原子有
则晶胞中每个Pd原子周围距离相等且最近的Pd原子有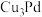 可看作上述Pd晶胞中
可看作上述Pd晶胞中
您最近一年使用:0次
名校
解题方法
4 . 已知元素X简单气态氢化物和其最高价含氧酸可化合生成一种盐,基态Y原子最外层电子排布为nsnnpn+2。下列说法错误的是
| A.原子半径:X>Y | B.X、Y均属于p区元素 |
| C.X、Y的电负性:X>Y | D.X、Y的简单氢化物热稳定性:X<Y |
您最近一年使用:0次
2022-04-21更新
|
180次组卷
|
6卷引用:云南省巍山彝族回族自治县第二中学2021-2022学年高二下学期6月第三次月考化学试题
名校
5 . 下列有关元素周期表及其分区的理解不正确的是
| A.元素周期表的每个周期中最后一种元素是稀有气体元素 |
| B.基态原子最外层电子排布为ns2的元素都位于周期表第IIA族 |
| C.主族元素处于元素周期表的s区和p区 |
| D.电负性最大的元素位于周期表的右上角(稀有气体除外) |
您最近一年使用:0次
2022-04-21更新
|
754次组卷
|
8卷引用:云南省巍山彝族回族自治县第二中学2021-2022学年高二下学期6月第三次月考化学试题
6 . 过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)过渡元素Co基态原子的核外电子排布式为_______ ;第四电离能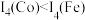 ,其原因是
,其原因是_______ 。
(2)Fe、Fe2+、Fe3+可以与CO、 、
、 、
、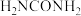 (尿素)等多种配体形成很多的配合物。
(尿素)等多种配体形成很多的配合物。
①配合物 的熔点为-20℃,沸点为103℃,可用于制备纯铁。
的熔点为-20℃,沸点为103℃,可用于制备纯铁。 的结构如图所示。下列关于
的结构如图所示。下列关于 说法不正确的是
说法不正确的是_______ (填序号)。
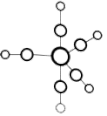
A. 是分子晶体
是分子晶体
B. 中Fe原子的配体与
中Fe原子的配体与 互为等电子体
互为等电子体
C. 中σ键与π键之比为1∶1
中σ键与π键之比为1∶1
D.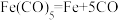 反应中没有新化学键生成
反应中没有新化学键生成
② 的电子式为
的电子式为_______ 。
③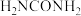 (尿素)中N原子的杂化方式为
(尿素)中N原子的杂化方式为_______ ,组成尿素的4种元素的第一电离能由大到小的顺序为_______ 。
(3)Ni和As形成某种晶体的晶胞图如图所示。其中,大球为Ni,小球为As,距离As最近的Ni构成正三支柱,其中晶胞下方As原子坐标为( ,
, ,
, )。
)。
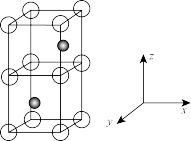
①Ni的配位数为_______ 。
②已知晶胞底面边长为apm,高为cpm,NA为阿伏加德罗常数。则晶胞密度为_______  。
。
(1)过渡元素Co基态原子的核外电子排布式为
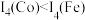 ,其原因是
,其原因是(2)Fe、Fe2+、Fe3+可以与CO、
 、
、 、
、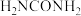 (尿素)等多种配体形成很多的配合物。
(尿素)等多种配体形成很多的配合物。①配合物
 的熔点为-20℃,沸点为103℃,可用于制备纯铁。
的熔点为-20℃,沸点为103℃,可用于制备纯铁。 的结构如图所示。下列关于
的结构如图所示。下列关于 说法不正确的是
说法不正确的是
A.
 是分子晶体
是分子晶体B.
 中Fe原子的配体与
中Fe原子的配体与 互为等电子体
互为等电子体C.
 中σ键与π键之比为1∶1
中σ键与π键之比为1∶1D.
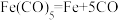 反应中没有新化学键生成
反应中没有新化学键生成②
 的电子式为
的电子式为③
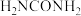 (尿素)中N原子的杂化方式为
(尿素)中N原子的杂化方式为(3)Ni和As形成某种晶体的晶胞图如图所示。其中,大球为Ni,小球为As,距离As最近的Ni构成正三支柱,其中晶胞下方As原子坐标为(
 ,
, ,
, )。
)。
①Ni的配位数为
②已知晶胞底面边长为apm,高为cpm,NA为阿伏加德罗常数。则晶胞密度为
 。
。
您最近一年使用:0次
7 . 当镁原子由1s22s22p63s2跃迁到1s22s22p63p2时,以下认识正确的是
| A.镁原子由基态转化成激发态,这一过程中吸收热量 |
| B.镁原子由基态转化成激发态,这一过程中释放热量 |
| C.转化后位于p能级上的两个电子的能量没有发生任何变化 |
| D.转化后镁原子与硅原子电子层结构相同,化学性质相似 |
您最近一年使用:0次
2022-04-12更新
|
29次组卷
|
2卷引用:云南省马关县第一中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
8 . 完成下列问题
(1)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co (II)双核配合物的内界。

①元素Co位于元素周期表中_______ 区,其基态原子次外层电子的运动状态有_______
种。
②下列状态的钴中,失去一个电子所需能量最大的是_______ (填序号)。
A.[Ar]3d74s2 B.[Ar]3d74s1 C.[Ar]3d74s14p1 D.[Ar]3d74p1
③配合物中每个中心离子的配位数为_______ 。
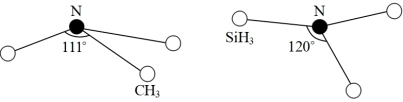
④由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3 (平面形)的结构如图所示,则N(SiH3)3中N的杂化方式为_______ ,更易形成配合物的是_______ 。
(2)①有机物甲醛是居室中常见的污染物之一,其结构为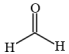 ,其中H—C—H间的键角略小于120°,原因是
,其中H—C—H间的键角略小于120°,原因是_______ 。
②离子化合物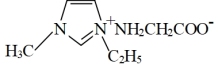 常温下为液态而非固态,原因是
常温下为液态而非固态,原因是_______ 。
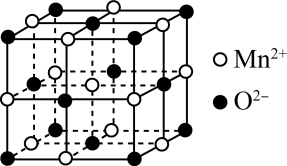
(3)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示,晶胞中距离最近的两个O2-之间的距离为a pm, MnO晶体的密度为ρg·cm-3,则阿伏加德罗常数的值为_______ (用含a和ρ的代数式表示)。
(1)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co (II)双核配合物的内界。

①元素Co位于元素周期表中
种。
②下列状态的钴中,失去一个电子所需能量最大的是
A.[Ar]3d74s2 B.[Ar]3d74s1 C.[Ar]3d74s14p1 D.[Ar]3d74p1
③配合物中每个中心离子的配位数为
④由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3 (平面形)的结构如图所示,则N(SiH3)3中N的杂化方式为

(2)①有机物甲醛是居室中常见的污染物之一,其结构为
 ,其中H—C—H间的键角略小于120°,原因是
,其中H—C—H间的键角略小于120°,原因是②离子化合物
 常温下为液态而非固态,原因是
常温下为液态而非固态,原因是(3)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示,晶胞中距离最近的两个O2-之间的距离为a pm, MnO晶体的密度为ρg·cm-3,则阿伏加德罗常数的值为

您最近一年使用:0次
名校
解题方法
9 . X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y位于元素周期表第_______ 周期第_______ 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是_______ (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在_______ 个σ键。在H—Y,H—Z两种共价键中,键的极性较强的是_______ ,键长较长的是_______ 。
(3)W的基态原子核外电子排布式是_______ 。
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在
(3)W的基态原子核外电子排布式是
您最近一年使用:0次
2022-04-06更新
|
84次组卷
|
2卷引用:云南省马关县第一中学2021-2022学年高二下学期2月份考试化学试题
名校
解题方法
10 . 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)画出碘原子的原子结构示意图:_______ , 画出与I同族的F原子的价电子排布图:_______ 。
(2)沸点大小: HF_______ HI (填“大于”“小于”或“等于”),原因是_______ 。
(3)基态K原子中,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为_______ 。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是_______ 。
(4)KIO3中IO 的几何构型为
的几何构型为_______ 中心原子的杂化形式为_______
(5)KH2PO4晶体具有优异的非线性光学性能,其晶体的四方晶胞如图(a)所示,图(b)、 图(c),分别显示的是H2PO 、K+ 在晶胞xz面、yz面上的位置:
、K+ 在晶胞xz面、yz面上的位置:
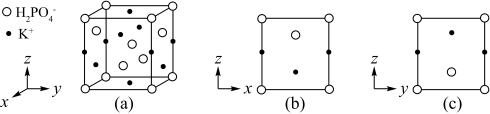
①若晶胞底边的边长均为a pm、高为c pm,阿伏加德罗常数的值为NA,晶体的密度为_______ g·cm-3 (写出表达式)。
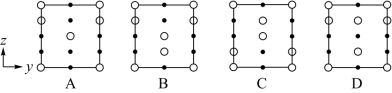
②晶胞在x轴方向的投影图为_______ (填序号)。
(1)画出碘原子的原子结构示意图:
(2)沸点大小: HF
(3)基态K原子中,核外电子占据最高能层的符号是
(4)KIO3中IO
 的几何构型为
的几何构型为(5)KH2PO4晶体具有优异的非线性光学性能,其晶体的四方晶胞如图(a)所示,图(b)、 图(c),分别显示的是H2PO
 、K+ 在晶胞xz面、yz面上的位置:
、K+ 在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为a pm、高为c pm,阿伏加德罗常数的值为NA,晶体的密度为
②晶胞在x轴方向的投影图为

您最近一年使用:0次



