名校
1 . 抗癌药阿霉素与环糊精在水溶液中形成超分子包合物,增大了阿霉素的水溶性,控制了阿霉素的释放速度,从而提高其药效。下列说法错误的是

| A.阿霉素分子中碳原子的杂化方式为sp2、sp3 |
| B.红外光谱法可推测阿霉素分子中的官能团 |
| C.阿霉素分子含有羟基、羧基和氨基 |
| D.阿霉素分子中,基态原子的第一电离能最大的元素为N |
您最近一年使用:0次
2023-04-03更新
|
2030次组卷
|
12卷引用:云南省凤庆县第一中学2022-2023学年高二下学期期中考试化学试题
云南省凤庆县第一中学2022-2023学年高二下学期期中考试化学试题黑龙江省哈尔滨第三中学2023届高三第二次模拟考试化学试题山东省菏泽市曹县第一中学2022-2023学年高二下学期3月月考化学试题 湖南省邵东市第一中学2022-2023学年高二下学期4月期中考试化学试题辽宁省凌源市实验中学2022-2023学年高二下学期4月月考化学试题广东省潮州市2022-2023学年高二下学期期末考试化学试题河南省焦作市博爱县第一中学2022-2023学年高二下学期6月期末考试化学试题辽宁省大连市第八中学2022-2023学年高二4月阶段测试化学试题湖南省长沙市雅礼中学2024届高三上学期月考试卷(一)化学试题辽宁省丹东市凤城市第一中学2023-2024学年高二下学期4月月考化学试题湖南省平江县颐华高级中学2023-2024学年高三下学期入学考试化学试题宁夏银川市贺兰县第一中学2023-2024学年高二下学期第二阶段考试化学试卷
名校
2 . 下列化学用语的描述正确的是
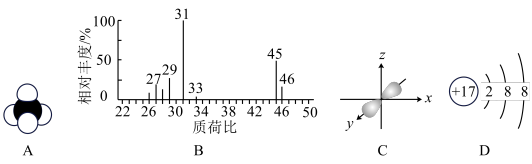

| A.CCl4的球棍模型 |
| B.测定CH3OH相对分子质量的质谱图 |
| C.锂原子最外层原子轨道示意图 |
| D.Cl-的结构示意图 |
您最近一年使用:0次
2023-03-26更新
|
268次组卷
|
3卷引用:云南省凤庆县第一中学2022-2023学年高二下学期期中考试化学试题
3 . 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的电子排布式为_______ 。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是_______ 分子(填“极性”或“非性极”)。
(3) 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
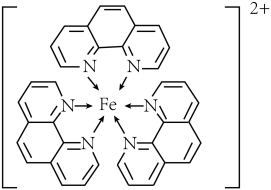
(4)如图所示的化合物,中心离子的配位数为_______ 。
(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:_______ 。
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为_______ ;已知晶胞边长为a pm,阿伏加德罗常数的值为 ,该晶胞密度
,该晶胞密度 为
为_______  (只列出计算式)。
(只列出计算式)。

(1)基态Ge原子的电子排布式为
(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是(3)
 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)如图所示的化合物,中心离子的配位数为

(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为 ,该晶胞密度
,该晶胞密度 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
4 . W、X、Y、Z、R是五种短周期主族元素,原子序数依次增大。W元素的一种离子与 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3∶2,X与Z同主族,Z的价电子排布式为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3∶2,X与Z同主族,Z的价电子排布式为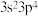 ,下列说法不正确的是
,下列说法不正确的是
 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3∶2,X与Z同主族,Z的价电子排布式为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3∶2,X与Z同主族,Z的价电子排布式为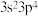 ,下列说法不正确的是
,下列说法不正确的是| A.最高价含氧酸的酸性:R>Z |
| B.W元素与X元素只能形成一种化合物 |
| C.Y和X构成的晶体具有较高的熔沸点 |
| D.Y、Z、R第一电离能:R>Z>Y |
您最近一年使用:0次
9-10高二下·辽宁锦州·期末
名校
解题方法
5 . 现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高正化合价:④>③=②>① |
您最近一年使用:0次
2022-12-21更新
|
4302次组卷
|
215卷引用:云南省通海县第一中学2021-2022学年高二下学期3月月考化学试题
云南省通海县第一中学2021-2022学年高二下学期3月月考化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期3月份考试化学试题云南省宁蒗彝族自治县第一中学2021-2022学年高二下学期3月考试化学试题云南省普洱市第一中学2021-2022学年高二下学期3月份考试化学试题云南省蒙自一中2021-2022学年高二下学期3月份考试化学试题云南省玉溪市峨山一中2018-2019学年高二12月份考试化学考试云南省景谷一中2018-2019学年高二下学期第一次月考化学试题天津市和平区2021-2022学年高二上学期线上期末质量检测化学试题山西省名校联考2021-2022学年高二上学期期末考试化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖南省邵阳市邵东市2021-2022学年高二上学期期末统考化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)湖北省鄂州市2021-2022学年高二上学期期末质量监测化学试题河南省郑州市第四高级中学2021-2022学年高二下学期第二次调研考试西藏班化学试题广东省十五校联盟2021-2022学年高二下学期第一次联考化学试题宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题重庆市育才中学2021-2022学年上学期高二上学期第六次定时练习化学试题内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期4月月考化学试题海南省东方中学2021-2022学年高二下学期第一次月考化学试题广东省揭阳市榕城区仙桥中学2021-2022学年高二下学期期中考试化学试题河南省开封市五县部分校2021-2022学年高二下学期期中考试化学试题安徽省蚌埠第三中学2021-2022学年高二下学期4月阶段测试化学试题重庆市朝阳中学2021-2022学年高二下学期第一次月考化学试题安徽省亳州市第二中学2021-2022学年高二下学期期末考试化学试题广东省广州市荔湾区2021-2022学年高二下学期期末考试化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)新疆乌苏市第一中学2021-2022学年高二下学期3月月考化学试题(加强班)新疆乌苏市第一中学2021-2022学年高二下学期3月月考化学试题(平行班)湖南省长沙市明达中学2021-2022学年高二上学期期末考试化学试题福建省三明市宁化第六中学2021-2022学年高二下学期第一次月考化学试题海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题陕西省西安市阎良区关山中学2021-2022学年高二下学期期末质量检测化学试题安徽省滁州市定远县育才学校2021-2022学年高二分层班下学期期中考试化学试题上海市建平中学2022-2023学年上学期高二10月月考化学(B卷)试题河北省石家庄市第二中学2022-2023学年高二上学期10月月考化学试题(已下线)第36讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第36讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(全国通用)海南省琼海市嘉积中学2022-2023学年高二上学期第二次月考(期中)化学试题河北省衡水市第二中学2022-2023学年高二上学期期中考试化学试题天津市南开中学2022-2023学年高三上学期第三次月考化学试题江西省九江市濂溪区第一中学2022-2023学年高二上学期期末考试化学试题云南省云南省楚雄彝族自治州民族中学2022-2023学年高二下学期6月月考化学试题四川省绵阳中学2022-2023学年高二上学期9月线上测试化学试题云南省玉溪市江川区第一中学、通海县第一中学2023-2024学年高二下学期4月联考化学试卷(已下线)09—10年锦州市高二下学期期末考试化学卷(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012学年福建省泉州一中高二下学期期中考试化学试卷(已下线)2012--2013学年新疆乌鲁木齐市一中高二下学期期中考试化学试卷(平行班)(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷(已下线)2012-2013学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2012-2013学年黑龙江省牡丹江一中高二下学期期末考试化学试卷(已下线)2012-2013学年福建省四地六校高二下学期第二次联考化学试卷(已下线)2013-2014学年浙江省瑞安中学高二上学期期中化学试卷(实验班)(已下线)2013-2014学年浙江省杭州及周边重点中学高二下学期期中化学试卷(已下线)2013-2014学年辽宁省鞍山市高二下学期期末考试化学(B卷)试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015福建省宁德市五校教学联合体高二下学期期中化学试卷2014-2015学年山东省淄博市高二下学期期末统考化学试卷2015-2016学年四川省雅安市天全中学高二9月月考化学试卷2015-2016学年四川省雅安中学高二上10月月考化学试卷2015-2016学年山西省太原五中高二下3月周练化学试卷2015-2016学年吉林省前郭县五中高二下学期第一次月考化学试卷2015-2016学年山西省康杰中学高二下期中化学试卷2015-2016学年山西省怀仁一中高二下第三次月考化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷2015-2016学年四川省成都市新都一中高二下4月月考化学试卷2015-2016学年新疆哈密二中高二下期末化学试卷2016-2017学年四川省三台中学校高二上月考化学试卷2017届山西省重点中学协作体高三上期中化学试卷2016-2017学年福建省三明市第一中学高二下学期第一次月考化学试卷2016-2017学年山西省太原市外国语学校高二下学期第一次月考化学试卷河北省石家庄市第一中学2016-2017学年高二下学期期中考试化学试题江西省玉山县第一中学2017届高三化学板块复习测试:物质结构与性质2018版化学(苏教版)高考总复习专题十一课时跟踪训练--原子结构与元素的性质宁夏石嘴山市第三中学2016-2017学年高二下学期期末(2018届高三入学)考试化学试题湖北省孝感市八所重点高中教学协作体2016-2017学年高二7月联合考试化学试题(B)安徽省蚌埠市第二中学2017-2018学年高二上学期期中考试化学试题福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二12月月考化学试题黑龙江省哈尔滨六中2017-2018学年高二12月月考化学试卷四川省凉山木里中学2017-2018学年高二上学期期中考试化学试卷内蒙古赤峰二中2017-2018学年高二上学期期末考试化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第2课时河南省豫西名校2017-2018学年高二下学期第一次联考化学试题山西省祁县中学2017-2018学年高二4月月考化学试题【全国校级联考】辽宁省抚顺市六校2017-2018学年高二下学期期末考试化学试题内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题陕西省黄陵中学2017-2018学年高二(重点班)下学期期末考试化学试题【全国百强校】福建省厦门外国语学校2018-2019学年高二上学期第一次月考化学试题四川省德阳市第五中学2018-2019学年高二上学期10月月考化学试题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题(已下线)2018年12月2日 《每日一题》 一轮复习-每周一测贵州省息烽县一中2018-2019学年高二11月份考试化学试题山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题福建省华安县第一中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】山西省实验中学2018-2019学年高二下学期第一次月考化学试题广西蒙山县第一中学2018-2019学年高二下学期第一次月考化学试题福建省罗源市第一中学2018-2019学年高二下学期3月月考化学试题吉林省乾安县第七中学2018-2019学年高二下学期第一次质量检测化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高二下学期4月月考化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题步步为赢 高二化学暑假作业:作业十四 物质结构与性质(选修3)新疆维吾尔自治区北京大学附属中学新疆分校2018-2019学年高二下学期期中考试化学试题【全国百强校】天津市静海区第一中学2018-2019学年高二下学期5月月考化学试题福建省莆田第八中学2018-2019学年高二下学期第二次月考化学试题福建省莆田第六中学2018-2019学年高二下学期期中考试(B卷)化学试题吉林省公主岭市范家屯镇第一中学2018-2019学年高二下学期期中考试化学试题辽宁省瓦房店市高级中学2018-2019学年高二下学期期末考试化学试题广西壮族自治区蒙山县第一中学2019-2020学年高二下学期期末考试化学试题广西蒙山一中2018-2019学年高二下学期期末考试化学试题(已下线)2019年11月22日 《每日一题》2020年高考化学一轮复习——电离能和电负性海南省三亚华侨学校2019-2020学年高二上学期期中考试化学试题宁夏石嘴山市第三中学2019-2020学年高二上学期期末考试化学试题四川省广元川师大万达中学2019-2020学年高二上学期期末教学质量检测化学试题四川省绵阳市三台县芦溪中学2017-2018学年高二上学期第五次月考化学试题2020届高三化学二轮物质结构题型专攻——基态原子核外电子排布【选择基础专练】2020届高中化学第一轮复习第十二章《物质结构与性质》测试卷人教化学选修3第一章第二节课时3内蒙古包头市包钢第四中学2018-2019学年高二下学期4月月考化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)四川省武胜烈面中学校2019-2020学年高二下学期开学考试化学试题四川省阆中中学2019-2020学年高一(仁智班)下学期开学考试化学试题安徽省蚌埠二中2019-2020学年高二下学期开学检测化学试题甘肃省兰州市第一中学2019-2020学年高二下学期4月月考化学试题安徽省滁州市明光市明光中学2019-2020高二下学期第二次月考化学试题河南省郑州市外国语学校2019-2020学年下学期高二第一次月考化学试题四川省越西中学2019-2020学年高二5月月考化学试题辽宁省营口市部分重点高中2017-2018学年高二下学期期末考试化学试题山西省朔州市第一中学2019-2020高二下学期5月月考化学试题山西省太原市阳曲县第一中学2019-2020学年高二5月复学检测化学试题湖北宜城市第二中学2019-2020学年高二下学期期中考试化学试题江苏省震泽中学2019-2020学年高一下学期期中考试(杨班)化学试题新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题安徽省池州市第一中学2019-2020学年高二下学期期中教学质量检测化学试题河北省沧州市任丘市第一中学2019-2020学年高二下学期开学考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(实验班)贵州省思南中学2019-2020学年高二下学期期中考试化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题海南省海口市2019-2020学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学等友好学校2019-2020学年高二下学期期末考试化学试题宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期末考试化学试题福建省龙岩市一级达标校2019-2020学年高二下学期期末质检化学试题(已下线)第34讲 原子结构与性质-2021年高考化学一轮复习名师精讲练四川省成都外国语学校2019-2020学年高二5月月考化学试题江苏省上冈高级中学2019-2020学年高二上学期期中考试化学(选修)试题湖北省武汉市五校联合体2019-2020学年高一下学期期末考试化学试题江苏宿迁泗阳县众兴中学2021届高三上学期调研考试化学试题四川省乐山沫若中学2020-2021学年高二上学期第一次月考化学试题四川省遂宁市安居区2020-2021学年高二上学期期中考试化学试题(已下线)第35讲 原子结构与性质(精练)-2021年高考化学一轮复习讲练测四川省遂宁市第二中学2020-2021学年高二上学期期中考试化学试题山东潍坊高密一中2020-2021学年高二上学期12月化学月考试题新疆哈密市第八中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质湖北省孝感市高级中学2020—2021学年高二下学期2月调研考试化学试题(已下线)第01章 原子结构与元素性质(B卷能力提升篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)福建省泉州市四校(晋江磁灶中学等)2019-2020学年高二下学期期中联考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题新疆乌苏市第一中学2020-2021学年高二3月月考化学(4-21班)试题福建省福州市福清西山学校2020-2021学年高二下学期3月月考化学试题福建省连城县第一中学2020-2021学年高二下学期第一次月考化学试题福建省莆田第二十五中学2020-2021学年高二下学期第一次月考化学试题四川省成都七中实验学校2020-2021学年高二下学期3月阶段性考试化学试题四川省成都市阳安中学2020-2021学年高二下学期3月月考化学试题福建省永安市第三中学2020-2021学年高二3月月考化学试题黑龙江省齐齐哈尔市第一中学2020-2021学年高二下学期4月月考化学试题湖北省鄂西北六校联考2020-2021学年高二下学期期中考试化学试题贵州省凯里市第三中学2020-2021学年高二下学期第一次月考化学试题湖北省宜城一中等五校联考2020-2021学年高二下学期期中考试化学试题四川省眉山市仁寿县四校2020-2021学年高二5月月考化学试题福建省莆田第十五中学2019-2020学年高二下学期期末考试化学试题江苏省常州市礼嘉中学2020-2021学年高二下学期第二次阶段质量调研化学试题(已下线)第36讲 原子结构与性质(精讲)-2022年一轮复习讲练测人教2019选择性必修2第一章 原子结构与性质复习与提高宁夏石嘴山市平罗中学2021-2022学年高二上学期期中考试化学试题浙江省诸暨市海亮高级中学2021-2022学年高二上学期期中考试化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高二上学期12月月考化学试题吉林省吉林松花江中学2022-2023学年高二上学期1月期末考试化学试题天津市天津中学2022-2023学年高二上学期线上期末考试化学试题(已下线)1.2.2 元素周期律-同步学习必备知识广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题湖北省十堰市普通高中协作体2022-2023学年高二下学期3月月考化学试题河北省石家庄市辛集市2022-2023学年高二上学期期末教学质量监测化学试题福建省龙岩第一中学2022-2023学年高二下学期第一次月考化学试题福建省永安市第三中学高中校2022-2023学年高三下学期第一次月考(3月)化学试题贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考化学试题江西省抚州市第一中学2022-2023学年高二下学期第一次月考化学试题福建省莆田第十五中学2022-2023学年高二下学期第一次月考(3月)化学试题广东省台山市第一中学2022-2023学年高二下学期第一次月考化学试题(已下线)专题01 原子结构与性质(知识串讲+专题过关)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)河南省洛阳市2022-2023学年高二下学期期中考试化学试题甘肃省高台县第一中学2022-2023学年高二下学期期中考试化学试题广东省佛山市顺德区郑裕彤中学2022-2023学年高二下学期期末模拟化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高二下学期期中考试化学试题内蒙古赤峰二中2022-2023学年高二下学期第二次月考化学试题广东省汕尾市华大实验学校2022-2023学年高二下学期5月月考化学试题河南省驻马店市环际大联考2022-2023学年高二下学期4月期中考试化学试题甘肃省庆阳第六中学2022-2023学年高二下学期期中考试化学试题海南省海口市第一中学2023-2024学年高二上学期第一次月考化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷贵州省黔西南布依族苗族自治州2023-2024学年高一上学期1月期末化学试题黑龙江省黑河市第一中学2023-2024学年高二下学期4月月考化学试题陕西省汉中市西乡县第一中学2023-2024学年高二下学期3月月考化学试题四川省内江市威远县威远中学校2023-2024学年高二下学期第一次月考化学试卷内蒙古赤峰新城红旗中学2023-2024学年高二下学期4月月考化学试题河北省石家庄市西山学校2023-2024学年高二上学期期末考试化学试题内蒙古自治区赤峰第四中学2023-2024学年高二下学期4月月考化学试题四川省泸州市泸州老窖天府中学2023-2024学年高二下学期5月期中考试化学试题安徽省蚌埠市皖北私立联考2023-2024学年高二下学期4月期中考试化学试题河北省石家庄市第四十一中学2023- 2024学年高二下学期期末考试化学试题
6 . 下列有关性质的比较中,正确的是
| A.微粒半径:O2-<F-<Na+<Li+ |
| B.第一电离能:He<Ne<Ar |
| C.共价键的键能:C-C<C=C<C≡C |
| D.分子中的键角:CH4>H2O>CO2 |
您最近一年使用:0次
2022-12-20更新
|
208次组卷
|
9卷引用:云南省楚雄彝族自治州民族中学2021-2022学年高二下学期3月月考化学试题
云南省楚雄彝族自治州民族中学2021-2022学年高二下学期3月月考化学试题天津耀华中学2021-2022学年高二下学期期末考试化学试题(已下线)专题14 分子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)吉林省白城市镇赉县第一中学校2021-2022学年高二下学期第一次月考化学试题2014-2015湖北省黄石市有色第一中学高二下学期期中考试化学试卷(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)天津市四校联考2023-2024学年高二下学期7月期末考试化学试题江苏省无锡市锡山高级中学2024-2025学年高二上学期开学考试化学试题
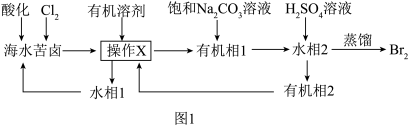
7 . Br2是一种重要的工业原料,沸点为59℃,微溶于水,有很强的挥发性和腐蚀性。海水苦卤含溴(Br-)高达60mg•L-1,是非常宝贵的化工资源。从苦卤中提溴的一种工艺流程如图1,回答下列问题:
(1)基态溴原子的价层电子排布式为____ 。
(2)①不同pH下,Cl2的用量即配氯率(实际通入Cl2和理论需要Cl2的体积比)与所得溶液中Br2的含量关系如图2所示。综合考虑,选择配氯率为和酸化的pH分别为____ 。
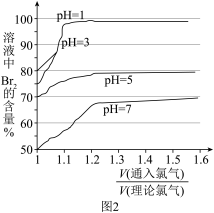
a.1.1,1 b.1.1,3 c.1.1,5 d.1,7
②用有机溶剂提溴的操作X名称为____ ,大部分卤代烃对环境不友好,所以工业上常用“乙酸仲丁酯”提溴,“有机相1”在原溶液的____ (填“上”或“下”)层。
③向“有机相1”中加入饱和Na2CO3溶液,Br2歧化为NaBrO3和NaBr,同时产生气体,写出化学方程式:____ ;向“水相2”中加入硫酸又可以得到Br2,离子方程式为____ 。
(3)某化学兴趣小组模拟“粗溴”蒸馏收集溴的过程,设计了如图3所示的实验装置。
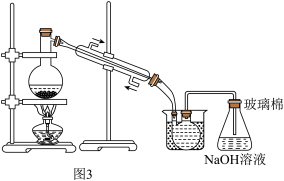
①实验过程中,蒸馏加热温度需控制80~90℃,再收集59℃的馏分。在图中补画出____ ,完成该控温实验操作,所需要的常用玻璃仪器____ 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是____ 。
(4)现有1m3含溴(Br-)60mg•L-1的海水苦卤,若整个流程中有20%的溴损失,最终可以制得Br2质量为____ 。

(1)基态溴原子的价层电子排布式为
(2)①不同pH下,Cl2的用量即配氯率(实际通入Cl2和理论需要Cl2的体积比)与所得溶液中Br2的含量关系如图2所示。综合考虑,选择配氯率为和酸化的pH分别为

a.1.1,1 b.1.1,3 c.1.1,5 d.1,7
②用有机溶剂提溴的操作X名称为
③向“有机相1”中加入饱和Na2CO3溶液,Br2歧化为NaBrO3和NaBr,同时产生气体,写出化学方程式:
(3)某化学兴趣小组模拟“粗溴”蒸馏收集溴的过程,设计了如图3所示的实验装置。

①实验过程中,蒸馏加热温度需控制80~90℃,再收集59℃的馏分。在图中补画出
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
(4)现有1m3含溴(Br-)60mg•L-1的海水苦卤,若整个流程中有20%的溴损失,最终可以制得Br2质量为
您最近一年使用:0次
名校
解题方法
8 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
| 0.1 mol∙L−1溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.原子半径:Y<W | B.元素第一电离能:Z>W |
| C.元素电负性:X<Z | D.简单氢化物的沸点:X<Z |
您最近一年使用:0次
名校
解题方法
9 . 近年来我国取得让世界瞩目的科技成果,化学功不可没。下列说法不正确的是
| A.“天和核心舱”电推进系统中的腔体采用氮化硼陶瓷属于新型无机非金属材料 |
| B.“神舟十三号”载人飞船返回舱的降落伞面料为芳纶,芳纶是有机高分子材料 |
| C.“嫦娥五号”运载火箭用液氧液氢推进剂,产物对环境无污染 |
| D.“奋斗者”号潜水器外壳材料为钛合金,22号钛元素在周期表中位于ds区 |
您最近一年使用:0次
名校
解题方法
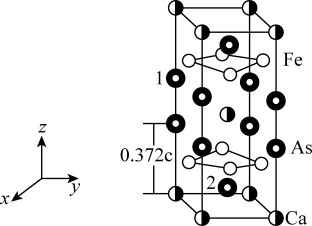
10 . 最近合成的一种铁基超导材料 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有_______ 种不同能级的电子。
(2) 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是_______ 。
(3)Fe可以与CO、NO、 等多种微粒形成配合物。
等多种微粒形成配合物。
①C、N、O的第一电离能由大到小的顺序为_______ 。
②写出 的一种等电子体分子
的一种等电子体分子_______ 。
(4) 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有_______ ,溶质阴离子的中心原子杂化轨道类型为_______ 。
(5)该材料的化学式为_______ ,已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为a pm、a pm、c pm,晶胞中As原子1分数坐标为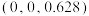 ,则As原子2的分数坐标为
,则As原子2的分数坐标为_______ 。
 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有
(2)
 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是(3)Fe可以与CO、NO、
 等多种微粒形成配合物。
等多种微粒形成配合物。①C、N、O的第一电离能由大到小的顺序为
②写出
 的一种等电子体分子
的一种等电子体分子(4)
 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有(5)该材料的化学式为
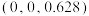 ,则As原子2的分数坐标为
,则As原子2的分数坐标为
您最近一年使用:0次
2022-11-13更新
|
104次组卷
|
2卷引用:福建省宁德市2022-2023学年高三上学期期中区域性学业质量检测化学试题



