名校
解题方法
1 . a、b、c、d、e、f分别是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:下图甲表示的是这六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。
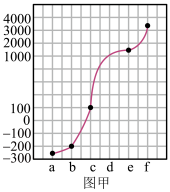
回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为___________ (用元素符号表示);
(2)元素b的单质的一个分子中含有___________ 个σ键和___________ 个π键;
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点___________ 乙的熔点(填>或<);
(4)元素d的基态原子的价电子排布式为___________ ;
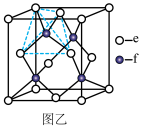
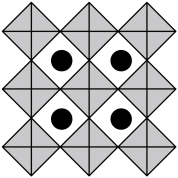
(5)元素e和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为___________ 丙的晶体类型为___________ ,在丙中,每个e原子周围最近的e原子数目为___________ 若晶胞参数为apm,则丙的密度表达式为___________ g・cm-3(用NA表示阿伏加德罗常数的值,丙的摩尔质量为Mg・mol-1)。

回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为
(2)元素b的单质的一个分子中含有
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点
(4)元素d的基态原子的价电子排布式为
(5)元素e和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为

您最近一年使用:0次
解题方法
2 . 金刚砂( )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。

(1)X是______ ?
(2)写出基态 原子的电子排布式
原子的电子排布式______ ; 中
中 的化合价是
的化合价是______ ?
(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角______
(4) 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是______ 晶体?请分析原因______
(5)在 中最小的环上有
中最小的环上有______ 个原子,已知 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是______ 。
 )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。
(1)X是
(2)写出基态
 原子的电子排布式
原子的电子排布式 中
中 的化合价是
的化合价是(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角
(4)
 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是(5)在
 中最小的环上有
中最小的环上有 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是
您最近一年使用:0次
3 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。_______ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: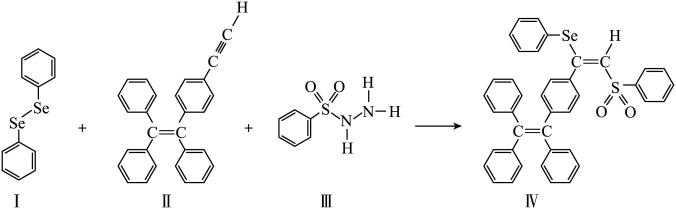
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
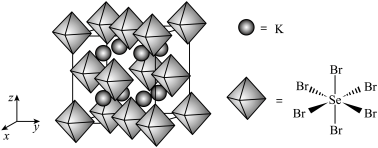
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2022-06-10更新
|
12624次组卷
|
28卷引用:专题九 物质结构与性质-实战高考·二轮复习核心突破
(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(17-21)(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山东省菏泽市单县二中2021-2022学年高二下学期期末测试化学试题山西省晋城市第一中学2022-2023学年高三上学期第五次调研考试化学试题(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)题型11 物质结构与性质的综合分析与推断(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)广东省广州中学2022-2023学年高二下学期期中考试化学试题江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)T35-物质结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷广东省汕头市金禧中学2023-024学年高三上学期第一次阶段考试化学试题上海市实验学校2023-2024学年高三上学期第一次月考化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学广东省广州市第六十五中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
4 . 钠离子电池是被认为在基于电网的储能系统中最具发展前景,双金属硫化物 空心纳米棒将有助于提高钠离子电池性能。回答下列问题:
空心纳米棒将有助于提高钠离子电池性能。回答下列问题:
(1) 位于第五周期,与N同主族,基态
位于第五周期,与N同主族,基态 的价电子排布图(轨道表达式)为
的价电子排布图(轨道表达式)为___________ ,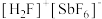 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 的空间构型为
的空间构型为___________ ,与 具有相同空间构型和键合形式的阴离子为
具有相同空间构型和键合形式的阴离子为___________ 。
(2) Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是___________ ,第一电离能由大到小的顺序是___________ 。
(3)与S同主族的元素有O、Se、Te等,它们氢化物的沸点大小为 ,其原因是
,其原因是___________ 。
(4)已知: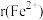 为
为 ,
, 为
为 。在隔绝空气条件下分别加热
。在隔绝空气条件下分别加热 和
和 ,实验测得
,实验测得 的分解温度低于
的分解温度低于 ,原因是
,原因是___________ 。
(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为___________ ;已知该晶体的密度为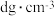 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
___________  (用含d和
(用含d和 的代数式表示)。
的代数式表示)。

 空心纳米棒将有助于提高钠离子电池性能。回答下列问题:
空心纳米棒将有助于提高钠离子电池性能。回答下列问题:(1)
 位于第五周期,与N同主族,基态
位于第五周期,与N同主族,基态 的价电子排布图(轨道表达式)为
的价电子排布图(轨道表达式)为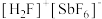 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 的空间构型为
的空间构型为 具有相同空间构型和键合形式的阴离子为
具有相同空间构型和键合形式的阴离子为(2) Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是
(3)与S同主族的元素有O、Se、Te等,它们氢化物的沸点大小为
 ,其原因是
,其原因是(4)已知:
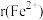 为
为 ,
, 为
为 。在隔绝空气条件下分别加热
。在隔绝空气条件下分别加热 和
和 ,实验测得
,实验测得 的分解温度低于
的分解温度低于 ,原因是
,原因是(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为
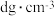 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
 (用含d和
(用含d和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2021-12-31更新
|
1192次组卷
|
4卷引用:八省八校(T8联考)2021-2022学年高三上学期第一次联考化学试题(石家庄二中)
八省八校(T8联考)2021-2022学年高三上学期第一次联考化学试题(石家庄二中)(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)2022年全国甲卷高考真题变式题(非选择题)吉林省双辽市一中、大安市一中、通榆县一中等重点高中2021-2022学年高三上学期期末联考理科综合化学试题
名校
解题方法
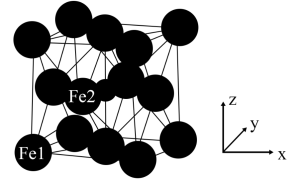
5 . 由于铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,受到研究人员的广泛关注。γˊ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去___________ 轨道电子,Fe3+价层电子排布图为___________ 。
(2)氨气中N的杂化类型是___________ ,NH3中H−N−H的键角比NH4+中H−N−H的键角___________ (填“大”或“小”),理由是___________ 。
(3) 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有___________ (填标号)。
A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是___________ ,配位原子为___________ 。
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为___________ 。
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为___________ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
(3)
 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
2021-12-31更新
|
288次组卷
|
5卷引用:石家庄示范性高中2022届高三上学期调研考试化学试题
2021高三·全国·专题练习
6 . 回答下列问题:
(1)①下列Li原子电子排布图表示的状态中,能量最低和最高的分别是____ (填标号)。
A、 B、
B、 C、
C、 D、
D、
②Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是____
(2)①Zn原子核外电子排布式为____
②黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能I1(Zn)___________ I1(Cu)(填“大于”或“小于”)。原因是___________ 。
(3)基态Fe原子价层电子的电子排布图(轨道表达式)为___________ ,基态S原子电子占据最高能级的电子云轮廓图为___________ 形。
(1)①下列Li原子电子排布图表示的状态中,能量最低和最高的分别是
A、
 B、
B、 C、
C、 D、
D、
②Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是
(2)①Zn原子核外电子排布式为
②黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能I1(Zn)
(3)基态Fe原子价层电子的电子排布图(轨道表达式)为
您最近一年使用:0次
名校
7 . 全固态激光器所用的磷酸钛氧钾、氟硼铍酸钾是一种非线性光学晶体,我国是率先掌握通过非线性光学晶体变频来获得深紫外激光技术的国家,回答下列问题。
(1)写出Ti基态原子的价电子排布式___________ , 电子占据的轨道数为
电子占据的轨道数为___________ 个。
(2)Be和B的第一电离能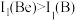 的原因是
的原因是___________ 。
(3) 在水溶液中存在解离反应:H
在水溶液中存在解离反应:H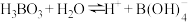 ,
, 中存在配位键,其中B原子的杂化类型是
中存在配位键,其中B原子的杂化类型是___________ ,从原子结构分析 中能形成配位键的原因是
中能形成配位键的原因是___________ 。
(4)氟硼酸钾是制备氟硼铍酸钾的原料之一,氟硼酸钾在高温下分解为KF和 ,二者的沸点分别为1500℃、-101℃。KF的沸点远高于
,二者的沸点分别为1500℃、-101℃。KF的沸点远高于 的原因是
的原因是___________ 。
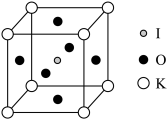
(5) 晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为
晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为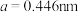 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___________ (保留三位有效数字)nm,与K紧邻的O个数为___________ 。
(1)写出Ti基态原子的价电子排布式
 电子占据的轨道数为
电子占据的轨道数为(2)Be和B的第一电离能
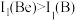 的原因是
的原因是(3)
 在水溶液中存在解离反应:H
在水溶液中存在解离反应:H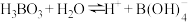 ,
, 中存在配位键,其中B原子的杂化类型是
中存在配位键,其中B原子的杂化类型是 中能形成配位键的原因是
中能形成配位键的原因是(4)氟硼酸钾是制备氟硼铍酸钾的原料之一,氟硼酸钾在高温下分解为KF和
 ,二者的沸点分别为1500℃、-101℃。KF的沸点远高于
,二者的沸点分别为1500℃、-101℃。KF的沸点远高于 的原因是
的原因是(5)
 晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为
晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为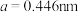 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
您最近一年使用:0次
解题方法
8 . 铝镍钴系永磁合金以铁,镍、铝元素为主要成分,还含有铜、钴、钛等元素.具有高剩磁和低温度系数,磁性稳定.现多用于仪表工业中制造磁电系仪表、流量计、微特电机,继电器等。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,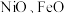 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为________ ,熔沸点:
____  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(2) 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是___________ 。
(3)氢能源发展的关键环节是新型储氢材料,氨硼烷 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
①氨硼烷分子中B原子采取_________ 杂化。
②氨硼烷晶体中存在的作用力有范德华力,极性键、________ 和________ 。
(4)立方氮化硼 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
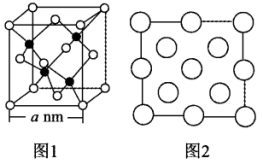
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置________ 。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,
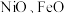 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(2)
 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是(3)氢能源发展的关键环节是新型储氢材料,氨硼烷
 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。①氨硼烷分子中B原子采取
②氨硼烷晶体中存在的作用力有范德华力,极性键、
(4)立方氮化硼
 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置
您最近一年使用:0次
名校
解题方法
9 . 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的; F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(注:A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(2)B的氯化物的熔点比MgO的熔点___________ (填“高”或“低”)。
(3)F的外围电子排布式是___________ 。
(4)A、F形成某种化合物的晶胞结构如图所示(其中A显−3价),则其化学式为___________ (每个球均表示1个原子)。
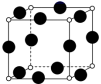
(5)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为___________ 。
(1)A、B、C、D的第一电离能由小到大的顺序为
(2)B的氯化物的熔点比MgO的熔点
(3)F的外围电子排布式是
(4)A、F形成某种化合物的晶胞结构如图所示(其中A显−3价),则其化学式为

(5)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为
您最近一年使用:0次
2021-10-19更新
|
205次组卷
|
2卷引用:江苏省淮安市涟水县第一中学2022届高三第一次阶段检测化学试卷
解题方法
10 . ⅢA、VA族元素组成的化合物 是人工合成的具有特殊功能的新材料,回答下列问题:
是人工合成的具有特殊功能的新材料,回答下列问题:
(1)基态B原子的电子排布式为___________ ;BN中B元素的化合价为___________ 。
(2)As基态原子的电子占据了___________ 个能层,最高能级的电子排布式为___________ ;和As位于同一周期,且未成对电子数也相同的元素还有___________ 种。
(3)元素周期表中与P紧邻的4种元素中电负性最大的是___________ (填元素符号):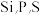 三种元素的第一电离能由大到小的顺序是
三种元素的第一电离能由大到小的顺序是___________ 。
(4)已知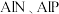 等半导体材料的晶体结构与单晶硅相似,则
等半导体材料的晶体结构与单晶硅相似,则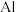 原子的杂化形式为
原子的杂化形式为___________ ;晶体结构中存在的化学键有___________ (填字母代号)。
A.离子键 B.σ键 C.π键 D.配位键
(5)立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为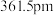 ,立方氮化硼的密度是
,立方氮化硼的密度是___________  (只要求列算式,不必计算出数值,阿伏加德罗常数为
(只要求列算式,不必计算出数值,阿伏加德罗常数为 )。
)。
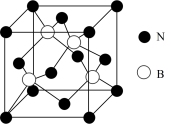
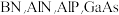 是人工合成的具有特殊功能的新材料,回答下列问题:
是人工合成的具有特殊功能的新材料,回答下列问题:(1)基态B原子的电子排布式为
(2)As基态原子的电子占据了
(3)元素周期表中与P紧邻的4种元素中电负性最大的是
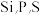 三种元素的第一电离能由大到小的顺序是
三种元素的第一电离能由大到小的顺序是(4)已知
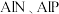 等半导体材料的晶体结构与单晶硅相似,则
等半导体材料的晶体结构与单晶硅相似,则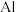 原子的杂化形式为
原子的杂化形式为A.离子键 B.σ键 C.π键 D.配位键
(5)立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为
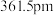 ,立方氮化硼的密度是
,立方氮化硼的密度是 (只要求列算式,不必计算出数值,阿伏加德罗常数为
(只要求列算式,不必计算出数值,阿伏加德罗常数为 )。
)。
您最近一年使用:0次



