名校
解题方法
1 . 一种La、Ba、Co、O等元素为代表的新型双钙钛矿阴极材料,晶胞结构如图所示,目前已成为低温固体氧化物燃料电池(IT-SOFCs)的一大研究热点(A点为Ba,A’点为La,B点为Co,晶胞为正方体,棱长为a pm)。下列回答错误的是
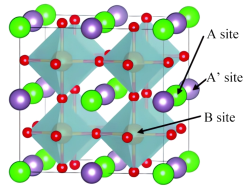

| A.该晶体的化学式为LaBaCo2O6 |
| B.距离Ba等距且最近的La的数目为12 |
C.该晶胞密度为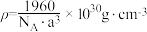 |
| D.Co元素在周期表中的位置为第四周期第Ⅷ族 |
您最近一年使用:0次
解题方法
2 . 下表列出了A~M 13种元素在周期表中的位置:
(1)这些元素中,金属性最强的元素是_______ (填元素符号,下同),非金属性最强的是_______ 。
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式_______ 。
(3)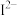 、
、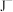 、
、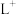 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是_______ ,最小的是_______ 。
(4)A与D形成的化合物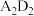 是
是_______ 化合物,其电子式为_______ 。
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式
(3)
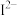 、
、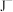 、
、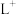 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是(4)A与D形成的化合物
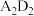 是
是
您最近一年使用:0次
名校
解题方法
3 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
(1)元素p为26号元素,请写出其基态原子的核外电子排布式:___________ ,其在元素周期表中的位置___________ 。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(3)o、p两元素的部分电离能数据如表2:
比较两元素的 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是___________ 。
(4)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是___________ (填元素符号),e的价电子排布图为___________ 。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p |
(1)元素p为26号元素,请写出其基态原子的核外电子排布式:
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(3)o、p两元素的部分电离能数据如表2:
元素 电离能(kJ/mol) | o | p |
| 717 | 759 |
| 1509 | 1561 |
| 3248 | 2957 |
比较两元素的
 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是(4)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是
您最近一年使用:0次
名校
解题方法
4 . 下列关于元素周期表及周期律的叙述,其中错误的是
①硫酸锶(SrSO4)是难溶于水的白色固体
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④卤素单质的熔点从F2到I2逐渐升高,碱金属单质的熔点从Li到Cs也逐渐升高
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀酸
①硫酸锶(SrSO4)是难溶于水的白色固体
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④卤素单质的熔点从F2到I2逐渐升高,碱金属单质的熔点从Li到Cs也逐渐升高
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀酸
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
名校
5 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
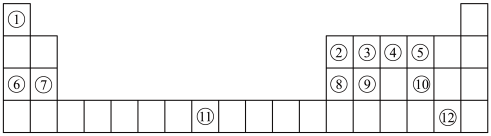
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
336次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
6 . 某学习小组探究B及其化合物的性质。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。
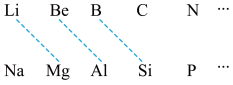
B在元素周期表中的位置是_______ 。其最高价氧化物的化学式为_______ ,与氢氧化钠溶液反应的化学方程式为_______ 。
(2)某科研团队研究发现硼氢化钠( )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
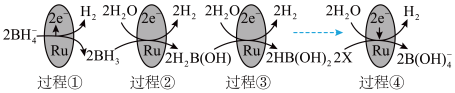
①上图中X的化学式为_______ 。
② 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用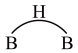 表示,则二聚物结构式为
表示,则二聚物结构式为_______ 。
③图中反应的总化学方程式为_______ 。
④_______ g 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。

B在元素周期表中的位置是
(2)某科研团队研究发现硼氢化钠(
 )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
①上图中X的化学式为
②
 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用 表示,则二聚物结构式为
表示,则二聚物结构式为③图中反应的总化学方程式为
④
 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
您最近一年使用:0次
名校
7 . 含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种原子序数为48的Cd2+配合物的结构如图所示,则下列说法正确的是
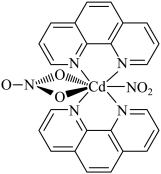

| A.该螯合物中N的杂化方式有2种 |
| B.1mol该配合物中通过螯合作用形成的配位键有6mol |
| C.Cd属于d区元素 |
| D.Cd的价电子排布式为4d85s2 |
您最近一年使用:0次
2022-11-07更新
|
897次组卷
|
3卷引用:四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
8 . 某固态结晶水合物 X 由 5 种元素组成。某学习小组进行了如下实验:
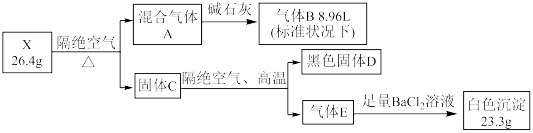
已知气体B能与 AgNO3 溶液反应, D中两种元素质量比为4:1 ,请回答:
(1)上述五种元素中,写出原子序数最大的元素在周期表中的位置___________
(2)气体 B 的实验方法是___________
(3)写出 X 在隔绝空气条件下加热,生成 A 、D 、E 的化学方程式:___________
(4)已知气体B和固体D加热时会发生反应,产物中有两种单质,当参加反应的 D 质量是1.2g时,所生成的两种单质的质量差为___________ g

已知气体B能与 AgNO3 溶液反应, D中两种元素质量比为4:1 ,请回答:
(1)上述五种元素中,写出原子序数最大的元素在周期表中的位置
(2)气体 B 的实验方法是
(3)写出 X 在隔绝空气条件下加热,生成 A 、D 、E 的化学方程式:
(4)已知气体B和固体D加热时会发生反应,产物中有两种单质,当参加反应的 D 质量是1.2g时,所生成的两种单质的质量差为
您最近一年使用:0次
名校
解题方法
9 . 砷(As)的某些化合物具有独特的性质与用途,如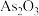 在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。
在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。 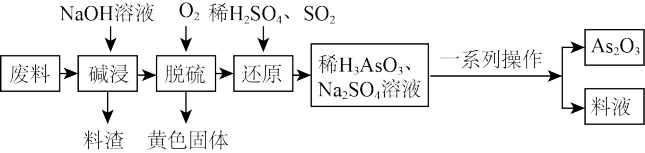
回答下列问题:
(1)砷与磷是同主族的相邻元素,其在周期表中的位置是_______ ,从物质化学性质角度看,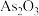 不可能是
不可能是_______ (填“酸”、“碱”或“两”)性氧化物。
(2)碱浸液中溶质主要为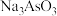 和
和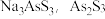 与NaOH反应的离子方程式:
与NaOH反应的离子方程式:_______ 。
(3)脱硫后以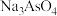 的形式存在,写出
的形式存在,写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。还原后砷以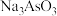 形式存在,则通入
形式存在,则通入 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为_______ 。
(4)还原后加热溶液,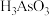 分解为
分解为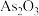 ,结晶得到相
,结晶得到相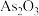 ,
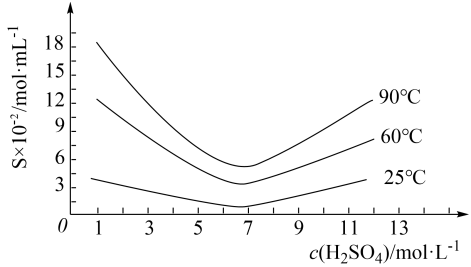
,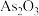 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗
在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗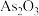 的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为_______ 。
(5)在工业生产中,最后一步所得滤液可循环使用,其目的是_______ 。
 在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。
在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。 
回答下列问题:
(1)砷与磷是同主族的相邻元素,其在周期表中的位置是
 不可能是
不可能是(2)碱浸液中溶质主要为
 和
和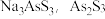 与NaOH反应的离子方程式:
与NaOH反应的离子方程式:(3)脱硫后以
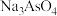 的形式存在,写出
的形式存在,写出 与
与 反应的化学方程式:
反应的化学方程式: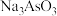 形式存在,则通入
形式存在,则通入 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(4)还原后加热溶液,
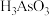 分解为
分解为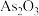 ,结晶得到相
,结晶得到相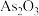 ,
,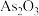 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗
在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗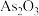 的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
(5)在工业生产中,最后一步所得滤液可循环使用,其目的是
您最近一年使用:0次
2022-10-12更新
|
354次组卷
|
2卷引用:山东省潍坊五县市2022-2023学年高三上学期10月质量检测联考化学试题
名校
10 . 一种从废弃SCR催化剂(主要含78%TiO2、V2O5及SiO2、Al2O3等)中回收钛、钒的工艺流程如图所示:

(1)Ti在周期表中的位置是_____________ ,价层电子排布式是________________ 。
(2)已知V2O5的化学性质与氧化铝相似,则“碱浸”过程中发生反应的离子方程式Al2O3+ 2OH-= 2AlO +H2O、
+H2O、__________ 、___________ 。
(3)沉淀X的主要成分是H2SiO3、_________ (填化学式)。
(4)在焙烧NH4VO3时,气体产物经过与_______ (填化学式)反应后,可以在生产流程中循环利用。
(5)反型钙钛矿电池使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
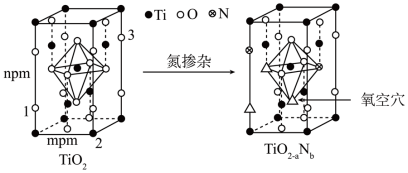
已知原子1、2的分数坐标为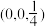 和
和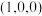 ,则原子3的坐标分别为
,则原子3的坐标分别为______ ,设阿伏加德罗常数的值为NA,TiO2的密度为_______ g·cm-3(列出计算式)。TiO2-aNb晶体中a=_______ 。

(1)Ti在周期表中的位置是
(2)已知V2O5的化学性质与氧化铝相似,则“碱浸”过程中发生反应的离子方程式Al2O3+ 2OH-= 2AlO
 +H2O、
+H2O、(3)沉淀X的主要成分是H2SiO3、
(4)在焙烧NH4VO3时,气体产物经过与
(5)反型钙钛矿电池使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

已知原子1、2的分数坐标为
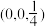 和
和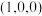 ,则原子3的坐标分别为
,则原子3的坐标分别为
您最近一年使用:0次




