1 . 完成下列问题:
(1)N、O、Mg、Al、S、Fe是常见的六种元素,按要求回答下列问题:
①Fe位于元素周期表第_____ 周期第_____ 族。
②基态N原子核外电子排布式为_____ ;基态O原子核外有_____ 种运动状态的电子。
③基态S原子核外电子占据的最高能级的电子云轮廓图为_____ 形。
④Mg、Al两种元素中第一电离能较大的是_____ 填元素符号)。
(2)几种元素的电负性数据如表:
①AlBr3的熔点_____ AlF3的熔点(填“大于”、“小于”或“等于”),原因是_____ 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为_____ 。
(1)N、O、Mg、Al、S、Fe是常见的六种元素,按要求回答下列问题:
①Fe位于元素周期表第
②基态N原子核外电子排布式为
③基态S原子核外电子占据的最高能级的电子云轮廓图为
④Mg、Al两种元素中第一电离能较大的是
(2)几种元素的电负性数据如表:
| O | F | Al | Br | …… |
| 3.5 | 4.0 | 1.5 | 2.8 | …… |
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为
您最近一年使用:0次
2 . 黑火药的爆炸反应原理为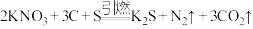 。请回答下列问题:
。请回答下列问题:
(1)基态 原子核外有
原子核外有___________ 种空间运动状态的电子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为___________ 。
(3)K位于周期表的___________ 区;基态钾离子的电子占据的最高能层符号是___________ 。
(4) 与
与 具有相同的电子构型,
具有相同的电子构型,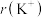 小于
小于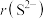 ,原因是
,原因是___________ 。
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是___________ 。
a.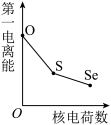 b.
b.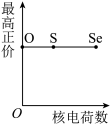 c.
c.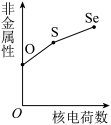 d.
d.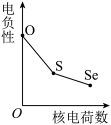
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能 。
。 的Born-Haber循环如图所示。
的Born-Haber循环如图所示。

由图可知, 原子的第二电离能为
原子的第二电离能为___________ 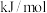 ;
; 键的键能为
键的键能为___________ 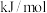 ;氧原子的第一电子亲和能为
;氧原子的第一电子亲和能为___________ 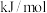 ;
; 的晶格能为
的晶格能为___________ 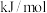 。
。
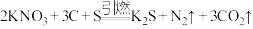 。请回答下列问题:
。请回答下列问题:(1)基态
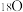 原子核外有
原子核外有(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为(3)K位于周期表的
(4)
 与
与 具有相同的电子构型,
具有相同的电子构型,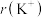 小于
小于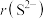 ,原因是
,原因是(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是
a.
 b.
b. c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能
 。
。 的Born-Haber循环如图所示。
的Born-Haber循环如图所示。
由图可知,
 原子的第二电离能为
原子的第二电离能为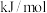 ;
; 键的键能为
键的键能为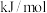 ;氧原子的第一电子亲和能为
;氧原子的第一电子亲和能为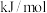 ;
; 的晶格能为
的晶格能为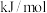 。
。
您最近一年使用:0次
名校
3 . 有H、C、O、Na、Mg、Al、P、Cl、Ar等9种元素或它们的原子。如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:(1)原子核对核外电子的吸引力(2)形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量( ):
):
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______ 。
(2)表中X可能为以上9种元素中的_______ (填写元素符号)元素。用元素符号表示X和地壳中含量占第一位的元素形成化合物的化学式_______ 。
(3)Y是周期表中_______ 族元素。
(4)以上9种元素中,_______ (填写字母)元素原子失去核外第一个电子需要的能量最多。
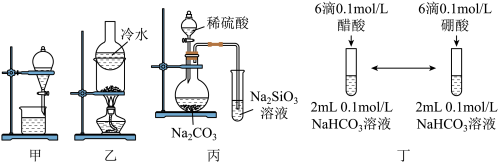
(5)下列实验装置符合题意且能达到相应实验目的的是_______。
 ):
):| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(2)表中X可能为以上9种元素中的
(3)Y是周期表中
(4)以上9种元素中,
(5)下列实验装置符合题意且能达到相应实验目的的是_______。

A.装置甲利用 提取苯中溶解的 提取苯中溶解的 |
B.装置乙分离 和 和 固体 固体 |
| C.装置丙验证非金属性S>C>Si(已知硅酸不溶于水) |
| D.装置丁比较醋酸与硼酸酸性(已知酸性醋酸>碳酸) |
您最近一年使用:0次
4 . 按照要求回答下列问题。
(1)有下列物质: 、
、 、
、 、
、 、
、 、
、 、
、 。
。
①上述物质中既含共价键又含离子键的__________ ;属于共价化合物的是__________ ;
② 溶于水时破坏
溶于水时破坏__________ (填“共价键”或“离子键”,下同), 熔化时破坏
熔化时破坏__________ 。
(2)砷在元素周期表中的位置__________ 。原子序数为115的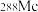 中子数为
中子数为__________ 。
(3)向 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为__________ 。可证明非金属性:
__________ S(填“>”或“<”)。
(4)短周期元素Y的一种含氧酸化学式为 ,其结构式可表示为
,其结构式可表示为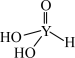 。该酸为
。该酸为__________ 元酸。写出该酸与过量 溶液反应的化学方程式:
溶液反应的化学方程式:__________ 。(用对应元素符号作答。已知信息:氢氧原子结合成的一种原子团“ ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
(1)有下列物质:
 、
、 、
、 、
、 、
、 、
、 、
、 。
。①上述物质中既含共价键又含离子键的
②
 溶于水时破坏
溶于水时破坏 熔化时破坏
熔化时破坏(2)砷在元素周期表中的位置
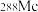 中子数为
中子数为(3)向
 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为
(4)短周期元素Y的一种含氧酸化学式为
 ,其结构式可表示为
,其结构式可表示为 。该酸为
。该酸为 溶液反应的化学方程式:
溶液反应的化学方程式: ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
您最近一年使用:0次
2023-03-24更新
|
661次组卷
|
3卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
5 . 立方砷化硼具有高载流子迁移率,超越硅的导热、导电性能,有望成为硅基元器件的替代方案,其晶胞结构如图所示,请回答下列问题:
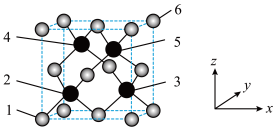
(1)As在元素周期表中的位置是_______ 。As属于_______ 区元素。
(2)该晶胞的化学式为_______ 。2、3、4、5四个原子所围成的空间结构为_______ 形。
(3)晶胞有两个基本要素。
①原子坐标参数,表示晶胞内部各原子的相对位置,图中1号原子的坐标参数为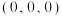 ,6号原子的坐标参数为
,6号原子的坐标参数为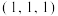 ,则2号原子的坐标参数为
,则2号原子的坐标参数为_______ 。
②晶胞参数是用来描述晶胞大小和形状的,设该晶胞的晶胞参数为a pm,阿伏加德罗常数为 ,则B、As原子之间的最短距离为
,则B、As原子之间的最短距离为_______ pm,该晶胞的密度为_______  。
。

(1)As在元素周期表中的位置是
(2)该晶胞的化学式为
(3)晶胞有两个基本要素。
①原子坐标参数,表示晶胞内部各原子的相对位置,图中1号原子的坐标参数为
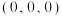 ,6号原子的坐标参数为
,6号原子的坐标参数为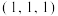 ,则2号原子的坐标参数为
,则2号原子的坐标参数为②晶胞参数是用来描述晶胞大小和形状的,设该晶胞的晶胞参数为a pm,阿伏加德罗常数为
 ,则B、As原子之间的最短距离为
,则B、As原子之间的最短距离为 。
。
您最近一年使用:0次
6 . 分子筛是一类具有规整孔道结构的多孔材料,能够选择性吸附空间结构各异和不同尺寸的分子,在化学工业中有着广泛的应用。近年来,我国科学家在分子筛研究领域不断取得新的突破。这些研究中涉及的部分元素在周期表中位置如下:
(1)近期我国科学家制备了一种无缺陷的分子筛膜,可高效分离CH4与CO2两种气体。下列有关分子空间结构的描述正确的是_______
(2)传统的分子筛主要含有O、Na、Al和Si元素,通过调控这 4种元素的比例,可获得不同性能的分子筛产品。这4种元素描述中正确的是_______ 。
(3)通过将分子筛中的元素Na替换为K或Ca,可改变分子筛的孔径大小。这3种元素中说法正确的是_______
(4)N2常用于分子筛的孔结构测试,H、O和N元素可形成多种物质。下列说法正确的是_______
(5)某些分子筛可以选择性吸附Ar。Ar位于元素周期表的_______
| 周期 | 族 | ||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 1 | H | ||||||
| 2 | C | N | O | ||||
| 3 | Na | Al | Si | ||||
| 4 | K | Ca | |||||
| A.CH4是平面结构 | B.CO2是V形结构 |
| C.CH4是正四面体结构 | D.CO2是直线形结构 |
| A.非金属性最强的是O |
| B.核外电子数最少的是 Na |
| C.金属性最强的是Al |
| D.原子半径最大的是Si |
| A.仅Na可与Cl2反应 |
| B.K的单质与水的反应最剧烈 |
| C.Na的氧化物与水的反应均为化合反应 |
| D.Ca的最高价氧化物的水化物碱性最强 |
| A.N2中含有共价三键 |
| B.NO可由NH3催化氧化得到 |
| C.NH3的水溶液呈碱性 |
| D.稀HNO3与Cu反应产生H2 |
| A.第二周期 | B.Ⅷ族 | C.第三周期 | D.0族 |
您最近一年使用:0次
名校
解题方法
7 . 实验室加热液体时常加入沸石,其主要成分为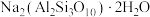 。根据其组成元素完成下列填空:
。根据其组成元素完成下列填空:
(1)元素Si在周期表中的位置是_______ 。
(2)沸石中的元素可形成多种化合物;Na元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为_______ ;化合物乙可作为呼吸面具或潜艇氧气的来源,乙是_______ (填化学式);Na与同周期非金属性最强的元素形成的化合物可做调味品,用电子式表示该化合物的形成过程_______ 。
(3)与氧元素同周期的非金属元素中,简单气态氢化物最稳定的是_______ (填化学式)。
(4)Na所在周期的主族元素中,简单离子半径最小的是_______ (填离子符号)
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则 中A=
中A=_______ 、Z=_______ 。
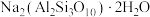 。根据其组成元素完成下列填空:
。根据其组成元素完成下列填空:(1)元素Si在周期表中的位置是
(2)沸石中的元素可形成多种化合物;Na元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为
(3)与氧元素同周期的非金属元素中,简单气态氢化物最稳定的是
(4)Na所在周期的主族元素中,简单离子半径最小的是
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则
 中A=
中A=
您最近一年使用:0次
8 . 分析下列图表,回答问题。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
则该元素是_______ (填写元素符号)。
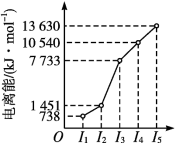
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第_______ 族。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价层电子排布式:_______ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/( kJ∙mol−1) | 578 | 1 817 | 2 745 | 11 575 | …… |
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第

(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| I1 | 717 | 759 | |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
您最近一年使用:0次
9 . 合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有_______ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为_______ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、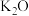 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为_______ ;第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为_______ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有_______ (填元素符号)
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置_______ ,基态Mn原子未成对的电子数为_______ 。
②第三电离能
_______ 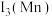 (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
(1)基态氮原子中,能量最高的电子的电子云在空间有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、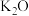 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置
②第三电离能

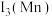 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
2023-02-14更新
|
670次组卷
|
3卷引用:山东省泰安市2022-2023学年高二上学期期末考试化学试题
解题方法
10 . 含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有NO等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O —— NaCl + HNO3 (未配平)。完成下列填空。
(1)氯在元素周期表中的位置是______________________________ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______________ (填化学式)。
(2)配平上述反应方程式_______ 。
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为____________ L。
(3)NaClO溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。
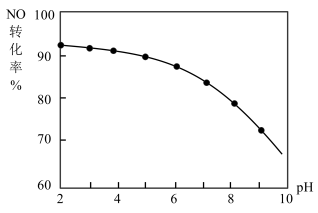
(4)NaClO溶液的初始pH越大,NO的转化率越________________ (填“高”或“低”),其原因是_____________________ 。取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为
(3)NaClO溶液中存在如下关系:c(OH-)
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。

(4)NaClO溶液的初始pH越大,NO的转化率越
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
滴加KI溶液 | 再滴加CCl4,振荡、静置 | 结论 | |
A试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
B试管 | 无现象 | 溶液分层,均无色 |
您最近一年使用:0次



