名校
1 . 下图是尚未完成的元素周期表,其中a、b、c、d、e、f为元素代号。_____
(2)在上图中用斜线阴影 标出过渡元素的范围。
标出过渡元素的范围。________
(3)在上图中用实线画出金属元素与非金属元素的分界线。________
(4)a原子在周期表中的位置是___________ ,写出a原子结构示意图___________ 。
(5)b和e两元素的原子以___________ (填化学键类型)形成化合物。
(6)b、c、d三种元素中,原子半径最大的是___________ (填元素名称),离子半径最大的是___________ (填离子符号)。
(7)写出c、d元素各自所形成的最高价氧化物对应的水化物之间发生的反应的离子方程式___________ 。
(8)b元素与其同主族元素的原子序数之差不可能是___________。
(9)下列有关元素周期表的叙述中,错误的是___________。

(2)在上图中用斜线阴影
 标出过渡元素的范围。
标出过渡元素的范围。(3)在上图中用实线画出金属元素与非金属元素的分界线。
(4)a原子在周期表中的位置是
(5)b和e两元素的原子以
(6)b、c、d三种元素中,原子半径最大的是
(7)写出c、d元素各自所形成的最高价氧化物对应的水化物之间发生的反应的离子方程式
(8)b元素与其同主族元素的原子序数之差不可能是___________。
| A.8 | B.16 | C.26 | D.44 |
| A.位于金属非金属分界线附近的元素既表现出金属的某些性质,又表现出非金属的某些性质 |
| B.人们在金属非金属分界线附近寻找高效催化剂 |
| C.元素b的最高价氧化物对应的水化物的酸性是最强的 |
| D.f是金属性最强的元素 |
您最近一年使用:0次
2023-05-01更新
|
236次组卷
|
2卷引用:上海市华东师范大学附属东昌中学2023-2024学年高三上学期第四次测试化学试卷
2 . C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为______ ;N、O、F的第一电离能由大到小的顺序为_____ (用元素符号表示)。
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为______ 晶体(填晶体类型)。
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第______ 周期第______ 族。
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO 的作用类型分别是
的作用类型分别是______ 、______ 。
A.离子键 B.配位键 C.氢键 D.金属键 中键角的大小并解释原因:
中键角的大小并解释原因:______ 。
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO
 的作用类型分别是
的作用类型分别是A.离子键 B.配位键 C.氢键 D.金属键
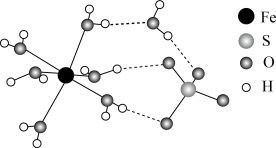
 中键角的大小并解释原因:
中键角的大小并解释原因:
您最近一年使用:0次
2023-04-20更新
|
197次组卷
|
3卷引用:陕西省西安市选课分科摸底考2023-2024学年高二下学期4月月考化学试题
名校
3 . 元素周期表体现了元素“位-构-性”的关系,下图是元素周期表的一部分,回答下列问题:
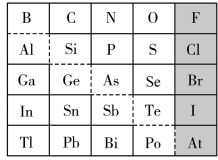
(1)Ga元素的原子结构示意图如图所示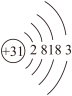 ,则其在元素周期表中的位置为
,则其在元素周期表中的位置为___________ 。
(2)Ge元素位于中金属元素和非金属元素的分界处,其最高正价为___________ ,可作___________ 材料使用;Bi元素的最高价氧化物为___________ (填化学式,下同);I元素的最高价氧化物对应的水化物为___________ 。
(3)以上元素中,失电子能力最强的元素是___________ ,非金属性最强的元素是___________ 。
(4)根据元素周期律等有关知识,推断:
①阴影部分元素对应的氢化物中最稳定的是___________ 。
② 、
、 、
、 、
、 ,四种离子半径由大到小的顺序:
,四种离子半径由大到小的顺序:___________ (用离子符号排序)。
③ 、
、 、
、 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:___________ 。

(1)Ga元素的原子结构示意图如图所示
 ,则其在元素周期表中的位置为
,则其在元素周期表中的位置为(2)Ge元素位于中金属元素和非金属元素的分界处,其最高正价为
(3)以上元素中,失电子能力最强的元素是
(4)根据元素周期律等有关知识,推断:
①阴影部分元素对应的氢化物中最稳定的是
②
 、
、 、
、 、
、 ,四种离子半径由大到小的顺序:
,四种离子半径由大到小的顺序:③
 、
、 、
、 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:
您最近一年使用:0次
名校
解题方法
4 . 根据所学知识,回答下列问题:
(1)写出C元素在元素周期表中的位置:___________ ;
(2)写出C与浓硫酸反应的化学方程式:___________ ;
(3)将胆矾晶体投入浓硫酸中,可观察到___________ ,体现了浓硫酸的___________ 性;
(4)除下列气体中的杂质所需要的试剂,括号内为杂质: (HCl)
(HCl)___________ ;NO( )
)___________
(1)写出C元素在元素周期表中的位置:
(2)写出C与浓硫酸反应的化学方程式:
(3)将胆矾晶体投入浓硫酸中,可观察到
(4)除下列气体中的杂质所需要的试剂,括号内为杂质:
 (HCl)
(HCl) )
)
您最近一年使用:0次
名校
5 . 如图是元素周期表的一部分,表中列出了八种元素的位置:
请回答下列问题:
(1)①元素的简单氢化物的电子式为______ 。
(2)在元素①-⑧中,金属性最强的元素是______ (填元素符号),最高价含氧酸酸性最强的是_____ (填化学式)。
(3)②、③、④三种元素的原子半径由大到小的顺序是_____ (填元素符号),③和⑦的简单氢化物的稳定性较强的是_____ (填化学式)。
(4)④和⑤所形成的化合物属于_____ (填“离子”或“共价”)化合物。
(5)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为_____ 。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①元素的简单氢化物的电子式为
(2)在元素①-⑧中,金属性最强的元素是
(3)②、③、④三种元素的原子半径由大到小的顺序是
(4)④和⑤所形成的化合物属于
(5)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为
您最近一年使用:0次
2023-04-09更新
|
479次组卷
|
2卷引用:湖南省岳阳教研联盟2022-2023学年高一下学期联考联评化学试题
6 . 回答下列问题:
(1)第四周期中,未成对电子数最多的元素是_______ 。(填名称)
(2)它位于第_______ 族。
(3)核外电子排布式是_______ 。
(4)它有_______ 个能层,_______ 个能级,_______ 种运动状态不同的电子。
(5)价电子排布图_______ 。
(6)属于_______ 区。
(1)第四周期中,未成对电子数最多的元素是
(2)它位于第
(3)核外电子排布式是
(4)它有
(5)价电子排布图
(6)属于
您最近一年使用:0次
7 . 原子序数为17的元素符号是_______ ,元素的原子的结构示意图是_______ ,位于周期表中第_______ 周期,_______ 族;最高化合价是_______ ,最低化合价是_______ ,氢化物中的化学键类型为_______ 。
您最近一年使用:0次
8 . 请写出元素周期表中前20号元素的名称及化学式_______ (例:铁 Fe)。
您最近一年使用:0次
9 . 回答下列问题:
(1)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为_______ 。SiCl4可发生水解反应,机理如下:
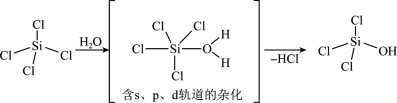
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为_______ (填标号)。
(2)四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
①元素Z位于周期表中第_______ 周期_______ 族;
②X、Y两元素的氢化物中,水溶液呈碱性的是_______ (写化学式)
③Y和Z的氢化物中,较稳定的是_______ (填化学式)。
④Y的最高价氧化物对应水化物的化学式为_______ 。
(1)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(2)四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X | Y | |
| Z | W |
①元素Z位于周期表中第
②X、Y两元素的氢化物中,水溶液呈碱性的是
③Y和Z的氢化物中,较稳定的是
④Y的最高价氧化物对应水化物的化学式为
您最近一年使用:0次
10 . 完成下列问题:
(1)N、O、Mg、Al、S、Fe是常见的六种元素,按要求回答下列问题:
①Fe位于元素周期表第_____ 周期第_____ 族。
②基态N原子核外电子排布式为_____ ;基态O原子核外有_____ 种运动状态的电子。
③基态S原子核外电子占据的最高能级的电子云轮廓图为_____ 形。
④Mg、Al两种元素中第一电离能较大的是_____ 填元素符号)。
(2)几种元素的电负性数据如表:
①AlBr3的熔点_____ AlF3的熔点(填“大于”、“小于”或“等于”),原因是_____ 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为_____ 。
(1)N、O、Mg、Al、S、Fe是常见的六种元素,按要求回答下列问题:
①Fe位于元素周期表第
②基态N原子核外电子排布式为
③基态S原子核外电子占据的最高能级的电子云轮廓图为
④Mg、Al两种元素中第一电离能较大的是
(2)几种元素的电负性数据如表:
| O | F | Al | Br | …… |
| 3.5 | 4.0 | 1.5 | 2.8 | …… |
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为
您最近一年使用:0次



