解题方法
1 . 铁是一种重要的元素,在成人体中的含量达44~5g,铁的配合物在有机合成、催化等领域中发挥重要作用。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如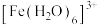 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),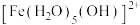 、
、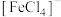 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。
(1)铁元素位于元素周期表的第___________ 周期第___________ 族。
(2)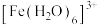 中,中心离子为
中,中心离子为___________ ,配位原子是___________ ,配位数为___________ 。
(3)加入NaCl溶液后,溶液又变为黄色的原因:___________ (用离子方程式表示)。
Ⅱ. 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。
(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有___________ ;推测维生素C在水中的溶解性:___________ (填“难溶于水”或“易溶于水”)。
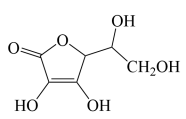
(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
②___________ 、___________ ;
③___________ 、___________ 、___________ 。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如
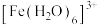 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),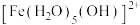 、
、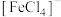 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。(1)铁元素位于元素周期表的第
(2)
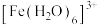 中,中心离子为
中,中心离子为(3)加入NaCl溶液后,溶液又变为黄色的原因:
Ⅱ.
 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有

(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
| 序号 | 结构特征 | 可反应的试剂 | 反应类型 |
| ① | 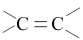 |  | 加成反应 |
| ② | 氧化反应 | ||
| ③ |
③
您最近一年使用:0次
2 . 已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中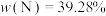 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
您最近一年使用:0次
名校
3 . 金属钛被誉为“二十一世纪金属”。回答下列问题:
(1)钛在周期表中的位置___________ ,位于元素周期表中___________ 区,钛原子核外有___________ 种空间运动状态不同的电子,Ti2+电子占据的最高能层的电子排布式为___________ 。
(2)TiO2的晶胞如图所示,则该晶体的密度为___________ g⋅cm-3 (设阿伏加德罗常数的值为NA,用含a、b、NA的代数式表示)。
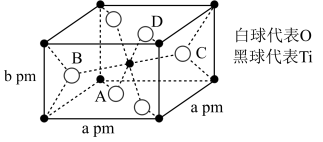
(1)钛在周期表中的位置
(2)TiO2的晶胞如图所示,则该晶体的密度为

您最近一年使用:0次
解题方法
4 . 铝镁合金是指以镁为主要添加元素的铝合金,在具有较高的强度、耐腐蚀性基础上拥有更低的密度,在电子、汽车、航天等领域有广阔的应用前景。
(1)Al在元素周期表中的位置是第三周期___________ 族。
(2)Al的最高价氧化物对应的水化物的化学式是___________ 。
(3)Al的金属性弱于Mg的,用原子结构解释原因:Al与Mg位于同一周期,原子核外电子层数相同,___________ ,失电子能力Al弱于Mg。
(4)下列实验或事实能说明Mg的金属性强于Al的是___________ (填字母)。
A.碱性: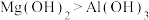
B.密度:Mg<Al
C.Mg能与热水缓慢反应,Al在热水中几乎不反应
(1)Al在元素周期表中的位置是第三周期
(2)Al的最高价氧化物对应的水化物的化学式是
(3)Al的金属性弱于Mg的,用原子结构解释原因:Al与Mg位于同一周期,原子核外电子层数相同,
(4)下列实验或事实能说明Mg的金属性强于Al的是
A.碱性:
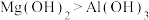
B.密度:Mg<Al
C.Mg能与热水缓慢反应,Al在热水中几乎不反应
您最近一年使用:0次
名校
5 . 下表是元素周期表的一部分,回答相关问题。
(1)元素①和⑦形成的化合物的化学式为___________ 。
(2)元素⑥的过氧化物的电子式___________ ,其最高价氧化物对应的水化物中含有的化学键类型为___________ 。
(3)元素⑥、⑦、⑧、⑨的简单离子半径由大到小的顺序为___________ (用离子符号表示);元素④、⑤、⑧、⑨的最简单氢化物中稳定性最强的是___________ (填化学式)。
(4)最近,德国科学家实现了铷原子气体超流体态与绝缘体态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。关于铷的下列说法不正确的是___________ (填序号)。
a.与水反应比钠反应更剧烈
b.单质具有很强的氧化性
c.Rb2O在空气中不会吸收水和二氧化碳
d.Rb2O2能与水剧烈反应并释放氧气
e.RbOH的碱性比同浓度的NaOH溶液弱
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)元素⑥的过氧化物的电子式
(3)元素⑥、⑦、⑧、⑨的简单离子半径由大到小的顺序为
(4)最近,德国科学家实现了铷原子气体超流体态与绝缘体态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。关于铷的下列说法不正确的是
a.与水反应比钠反应更剧烈
b.单质具有很强的氧化性
c.Rb2O在空气中不会吸收水和二氧化碳
d.Rb2O2能与水剧烈反应并释放氧气
e.RbOH的碱性比同浓度的NaOH溶液弱
您最近一年使用:0次
2023-06-15更新
|
122次组卷
|
2卷引用:湖南省湘潭县一中2022-2023学年高一下学期期末考试化学试题
名校
6 . 元素在周期表中的位置,反映了元素的原子结构和性质。如图是元素周期表的一部分,请按照要求回答下列问题:
(1)①的元素符号是______ ,元素②位于周期表中的第______ 周期第______ 族。
(2)②、③两种元素中,非金属性较强的是______ (填元素符号)
(3)①、②、④三种元素中,原子半径最大的是______ (填元素符号)。
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是______ (填化学式)。
(5)常温下,将元素⑥的单质通入 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式______
| 族 周期 | IA | 0 | ||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | |||||
(2)②、③两种元素中,非金属性较强的是
(3)①、②、④三种元素中,原子半径最大的是
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是
(5)常温下,将元素⑥的单质通入
 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式
您最近一年使用:0次
2023-06-08更新
|
180次组卷
|
2卷引用:云南省宣威市第三中学2023-2024学年高二上学期第二次月考化学试题
解题方法
7 . 水泥是人类最伟大的发明之一,主要成分为硅酸三钙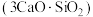 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为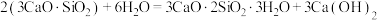 。回答下列问题:
。回答下列问题:
(1)为了加快硅酸三钙与水的反应速率,可采用的方式为_______ (填一种即可)。
(2)Si在元素周期表中的位置为_______ 。
(3) 的电子式为
的电子式为_______ , 的空间结构为
的空间结构为_______ 。
(4)元素C、O、Si、Ca的原子半径由大到小的顺序为_______ 。
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为_______ (用化学方程式表示)。
(6)写出 在农业上的一种用途:
在农业上的一种用途:_______ 。
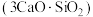 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为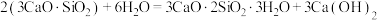 。回答下列问题:
。回答下列问题:(1)为了加快硅酸三钙与水的反应速率,可采用的方式为
(2)Si在元素周期表中的位置为
(3)
 的电子式为
的电子式为 的空间结构为
的空间结构为(4)元素C、O、Si、Ca的原子半径由大到小的顺序为
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为
(6)写出
 在农业上的一种用途:
在农业上的一种用途:
您最近一年使用:0次
2023-06-07更新
|
62次组卷
|
2卷引用:广东省汕头市2022-2023学年高一下学期4月期中考试化学试题
8 . 根据元素周期表中1~20号元素的性质和递变规律,回答下列问题:
(1)原子序数为8的元素名称是______ ;
(2)硫化氢的电子式是______ ;
(3)氟(F)和氯(Cl)均为第ⅦA族元素,则两种元素的非金属性强弱是F______ (填“>”或“<”)Cl;
(4)钾和硫两种元素的最高价氧化物对应的水化物相互反应的离子方程式为____________ 。
(1)原子序数为8的元素名称是
(2)硫化氢的电子式是
(3)氟(F)和氯(Cl)均为第ⅦA族元素,则两种元素的非金属性强弱是F
(4)钾和硫两种元素的最高价氧化物对应的水化物相互反应的离子方程式为
您最近一年使用:0次
9 . 化学是一门实用性很强的科学。请根据题意填空:
(1)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有______ (填“钠”或“钾”)元素;
(2)在金属元素中,有一类金属既可单独使用,也可用于生产合金。在合金中加入该类金属,能大大改善合金的性能,因而,该类金属又被称为“冶金工业的维生素”。则该类金属是______ (填“稀土金属”或“碱土金属”);
(3)中国古代最早的指南针“司南”,其具有磁性作用是因为主要含有______ (填“Fe2O3”或“Fe3O4”)。
(1)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有
(2)在金属元素中,有一类金属既可单独使用,也可用于生产合金。在合金中加入该类金属,能大大改善合金的性能,因而,该类金属又被称为“冶金工业的维生素”。则该类金属是
(3)中国古代最早的指南针“司南”,其具有磁性作用是因为主要含有
您最近一年使用:0次
解题方法
10 . 羟胺(NH2OH)是一种不稳定的白色固体,在有机合成中可用作还原剂。
(1)N在元素周期表中位于第二周期第______ 族。
(2)写出N的最高价氧化物对应的水化物的化学式______ 。
(3)O的非金属性强于N的,用原子结构解释原因:O和N在同一周期,原子核外电子层数相同,______ ,得电子能力O强于N。
(4)在元素周期表中,硒(Se)位于第四周期,与O同主族。下列关于Se的推断中,正确的是______ (填字母)。
a.原子最外层电子数为6
b.热稳定性:H2Se>H2O
c.原子半径:Se>O
(1)N在元素周期表中位于第二周期第
(2)写出N的最高价氧化物对应的水化物的化学式
(3)O的非金属性强于N的,用原子结构解释原因:O和N在同一周期,原子核外电子层数相同,
(4)在元素周期表中,硒(Se)位于第四周期,与O同主族。下列关于Se的推断中,正确的是
a.原子最外层电子数为6
b.热稳定性:H2Se>H2O
c.原子半径:Se>O
您最近一年使用:0次



