名校
解题方法
1 . 我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素A、B、C、D,原子序数依次增大,最外层电子数之和为15。B、C、D为同周期相邻元素,A为地壳中含量最多的元素。回答下列问题:
(1)元素D在周期表中的位置为___ ,A、C的简单离子半径大小顺序为___ (填离子符号)。
(2)化合物BA的电子式为___ (填元素符号)。A和D形成的化合物中的化学键类型为___________ 。
(3)B和C两元素相比较,金属性较强是___ (填元素符号),可以证明该结论的实验___ 。
A.比较两种元素的单质与冷的浓硫酸反应的速率
B.比较两种元素最高价氧化物对应的水化物的碱性
C.将相同大小的两种元素单质分别放入沸水中,观察反应现象
D.比较相同物质的量的两种元素的单质与足量稀盐酸反应产生 的多少
的多少
(1)元素D在周期表中的位置为
(2)化合物BA的电子式为
(3)B和C两元素相比较,金属性较强是
A.比较两种元素的单质与冷的浓硫酸反应的速率
B.比较两种元素最高价氧化物对应的水化物的碱性
C.将相同大小的两种元素单质分别放入沸水中,观察反应现象
D.比较相同物质的量的两种元素的单质与足量稀盐酸反应产生
 的多少
的多少
您最近一年使用:0次
2022-07-05更新
|
324次组卷
|
3卷引用:甘肃省张掖市某校2023-2024学年高三下学期模拟考试化学试题
甘肃省张掖市某校2023-2024学年高三下学期模拟考试化学试题广西柳州市2023届新高三摸底考试化学试题(已下线)第16讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(全国通用)
名校
2 . 已知A、B、C、D、E五种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,C与A同主族;A与B、D、E所形成的常见化合物在常温下均呈气态,在周期表中D与E左右相邻,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数与E的最外层电子数相同。
请回答下列问题:
(1)B在元素周期表的位置为________________________ 。
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序为_________ (用离子符号表示)。
(3)A、B、E可组成一种化合物,其原子个数之比为4:1:1,该化合物的水溶液与C的最高价氧化物的水化物反应的离子方程式为__________________________________________________ 。
(4)B的一种氢化物分子中含有18个电子,其化学式为_________________ 。
(5)BE3在常温下是一种淡黄色的液体,遇水即发生水解可生成一种具有漂白性的物质和一种核外电子总数为10的气体,写出该反应的化学方程式_________________________________ 。
(6)下列事实能证明D与E非金属性强弱的是__________ (选填字母序号)。
A.比较这两种元素的气态氢化物的沸点 B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(7)已知D、E两种元素形成的化合物H,H结构与过氧化氢相似。5.4g的H中含有的电子数目为_______________ 。
请回答下列问题:
(1)B在元素周期表的位置为
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序为
(3)A、B、E可组成一种化合物,其原子个数之比为4:1:1,该化合物的水溶液与C的最高价氧化物的水化物反应的离子方程式为
(4)B的一种氢化物分子中含有18个电子,其化学式为
(5)BE3在常温下是一种淡黄色的液体,遇水即发生水解可生成一种具有漂白性的物质和一种核外电子总数为10的气体,写出该反应的化学方程式
(6)下列事实能证明D与E非金属性强弱的是
A.比较这两种元素的气态氢化物的沸点 B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(7)已知D、E两种元素形成的化合物H,H结构与过氧化氢相似。5.4g的H中含有的电子数目为
您最近一年使用:0次
名校
解题方法
3 . 如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
(1)③、④、⑦的原子半径由大到小的顺序是___________ (用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______ 。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol②单质比l mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________ 。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________ 。
(5)已知W+X=Y+Z(反应需要加热),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________ 。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
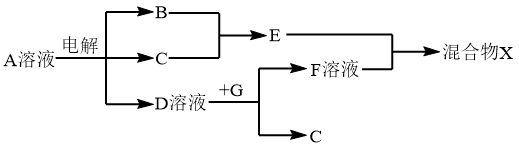
①写出D溶液与G反应的离子方程式_______________ 。
②写出检验A溶液中溶质的阴离子的方法_______________ 。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑧ | ⑨ | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol②单质比l mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式
(5)已知W+X=Y+Z(反应需要加热),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的离子方程式
②写出检验A溶液中溶质的阴离子的方法
您最近一年使用:0次
2018-01-04更新
|
159次组卷
|
2卷引用:甘肃省天水市第一中学2017-2018学年度上学期高三第三阶段考试化学试题
真题
解题方法
4 . 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
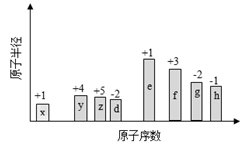
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________ 。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______ >__________ ;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______ >__________ 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________ 。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________ 。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
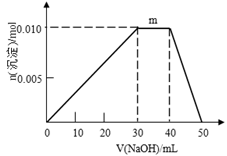
①R离子浓度由大到小的顺序是:__________ 。
②写出m点反应的离子方程式_________________ 。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______ mol。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是
(2)比较d、e常见离子的半径的小(用化学式表示,下同)
(3)任选上述元素组成一种四原子共价化合物,写出其电子式
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

①R离子浓度由大到小的顺序是:
②写出m点反应的离子方程式
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
2016-12-09更新
|
2589次组卷
|
5卷引用:2016届甘肃省会宁一中高三上学期第四次月考理综化学试卷
11-12高三上·甘肃兰州·期中
解题方法
5 . 有A、B、C、D、E五种短周期元素,其元素特征信息如下表
(1)E元素的名称是__________ 。
(2)A、B、C形成的化合物的电子式为__________________ ,该化合物中含有的化学键是________________ 。
(3)B、C、D的简单离子半径由大到小的顺序是(用离子符号表示)_________________ 。
(4)①E单质与A、B、C形成的化合物反应的化学方程式为____________________ ;
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式为__________________ ;
③B、C元素形成的两种化合物与A2B反应的两个化学方程式:__________ 、_________
| 编号 | 元素特征信息 |
| A | 其单质是密度最小的物质。 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一。 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物。 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)E元素的名称是
(2)A、B、C形成的化合物的电子式为
(3)B、C、D的简单离子半径由大到小的顺序是(用离子符号表示)
(4)①E单质与A、B、C形成的化合物反应的化学方程式为
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式为
③B、C元素形成的两种化合物与A2B反应的两个化学方程式:
您最近一年使用:0次
2011·甘肃天水·模拟预测
解题方法
6 . A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E原子序数的二倍。E阳离子与D阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A________ ,E___________ 。
(2)D在周期表中位于第_________ 周期,第_______ 族。
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)__________________ 。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式____________________________ 。
(5)0.5mol BD与A2D完全反应转移的电子数为_________ mol。
(1)写出元素符号:A
(2)D在周期表中位于第
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式
(5)0.5mol BD与A2D完全反应转移的电子数为
您最近一年使用:0次



