解题方法
1 . 已知A、B、C、D、E、F为短周期元素,其中C的原子序数最小,它们的最高正价与原子半径关系如图所示。
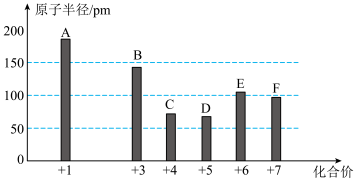
请回答下列问题:
(1)B元素在周期表中的位置为__________ ;D元素能与氢元素组成18电子分子,该分子含有的共价键类型为__________ (填“极性键”或“非极性键”)。
(2)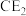 属于严禁携带的易燃易爆液体,其电子式为
属于严禁携带的易燃易爆液体,其电子式为__________ ;A、E、F三种元素形成的简单离子,半径由大到小的顺序是__________ (用离子符号表示)。
(3)写出元素A、B的最高价氧化物的水化物相互反应的离子方程式__________ 。
(4)用C元素的最简单氢化物和 在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的
在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的__________ 极,若线路中转移2mol电子,则消耗的 在标准状况下的体积为
在标准状况下的体积为__________ 。
(5)化合物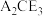 在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向
在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向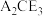 溶液中滴加酸性
溶液中滴加酸性 溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式__________ 。

请回答下列问题:
(1)B元素在周期表中的位置为
(2)
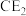 属于严禁携带的易燃易爆液体,其电子式为
属于严禁携带的易燃易爆液体,其电子式为(3)写出元素A、B的最高价氧化物的水化物相互反应的离子方程式
(4)用C元素的最简单氢化物和
 在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的
在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的 在标准状况下的体积为
在标准状况下的体积为(5)化合物
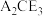 在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向
在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向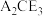 溶液中滴加酸性
溶液中滴加酸性 溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
2 . 前四周期元素A、B、C、D、E、F、G、H的原子序数依次增大,在元素周期表中A的原子半径最小,B与C相邻且C的最外层电子数是次外层的3倍,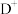 与
与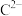 具有相同的电子层结构,E是地壳中含量最多的金属元素,F与C同主族,DGC是一种常见的漂白性物质,H原子的最外层只有1个电子,内层属于全满状态。回答下列问题:
具有相同的电子层结构,E是地壳中含量最多的金属元素,F与C同主族,DGC是一种常见的漂白性物质,H原子的最外层只有1个电子,内层属于全满状态。回答下列问题:
(1)C在元素周期表中的位置为___________ , 的离子结构示意图
的离子结构示意图___________ 。
(2)C和D也可形成一种漂白性物质,其电子式为___________ ,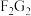 是
是___________ 键(填“极性键”或“非极性键”)构成的___________ 分子(填“极性”或“非极性”)。
(3)比较C和F简单氢化物的键角大小:___________ (用化学式表示),F和G的最高价氧化物的水化物酸性较强的是___________ (用化学式表示)。
(4)比较C、D、E三者离子半径的大小:___________ (用离子符号表示)。
(5)下列叙述正确且能用于比较元素D和E金属性强弱的是___________(填序号)。
(6)过量的 与G的单质的反应方程式:
与G的单质的反应方程式:___________ 。
(7)H的氢氧化物可溶于B的简单氢化物对应的水溶液反应,其离子方程式为___________ 。
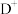 与
与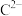 具有相同的电子层结构,E是地壳中含量最多的金属元素,F与C同主族,DGC是一种常见的漂白性物质,H原子的最外层只有1个电子,内层属于全满状态。回答下列问题:
具有相同的电子层结构,E是地壳中含量最多的金属元素,F与C同主族,DGC是一种常见的漂白性物质,H原子的最外层只有1个电子,内层属于全满状态。回答下列问题:(1)C在元素周期表中的位置为
 的离子结构示意图
的离子结构示意图(2)C和D也可形成一种漂白性物质,其电子式为
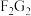 是
是(3)比较C和F简单氢化物的键角大小:
(4)比较C、D、E三者离子半径的大小:
(5)下列叙述正确且能用于比较元素D和E金属性强弱的是___________(填序号)。
| A.在化合物中E的化合价比D的高 |
| B.E的单质不能与冷水反应而D的单质能 |
| C.E的最高价氧化物对应水化物的碱性比D弱 |
| D.D的单质无法从E的盐溶液中置换出E |
 与G的单质的反应方程式:
与G的单质的反应方程式:(7)H的氢氧化物可溶于B的简单氢化物对应的水溶液反应,其离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 一种新型硫酸盐功能电解液由 和
和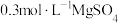 混合组成,电化学测试表明该电解液构建的
混合组成,电化学测试表明该电解液构建的 、
、 电池可以稳定循环500次以上。
电池可以稳定循环500次以上。
(1) 中三种原子的半径由小到大的顺序是
中三种原子的半径由小到大的顺序是_____ (用元素符号表示),其中电负性最大的元素是_____ (填名称)。
(2)第一电离能 的原因是
的原因是_____ 。
(3) 中,基态
中,基态 核外电子的空间运动状态有
核外电子的空间运动状态有_____ 种, 中
中 键和
键和 键的数目之比为
键的数目之比为_____ 。
(4) 中磷原子的杂化类型是
中磷原子的杂化类型是_____ 。
(5)N、O两种元素形成的简单氢化物的键角:
_____  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是_____ 。
(6) 的立方晶胞结构如图所示。已知晶胞的边长为npm,设
的立方晶胞结构如图所示。已知晶胞的边长为npm,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
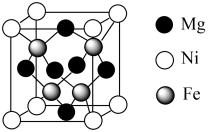
①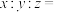
_____ 。
②该晶体密度是_____  (用含n、
(用含n、 的代数式表示)。
的代数式表示)。
 和
和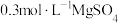 混合组成,电化学测试表明该电解液构建的
混合组成,电化学测试表明该电解液构建的 、
、 电池可以稳定循环500次以上。
电池可以稳定循环500次以上。(1)
 中三种原子的半径由小到大的顺序是
中三种原子的半径由小到大的顺序是(2)第一电离能
 的原因是
的原因是(3)
 中,基态
中,基态 核外电子的空间运动状态有
核外电子的空间运动状态有 中
中 键和
键和 键的数目之比为
键的数目之比为(4)
 中磷原子的杂化类型是
中磷原子的杂化类型是(5)N、O两种元素形成的简单氢化物的键角:

 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是(6)
 的立方晶胞结构如图所示。已知晶胞的边长为npm,设
的立方晶胞结构如图所示。已知晶胞的边长为npm,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①
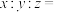
②该晶体密度是
 (用含n、
(用含n、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-09-21更新
|
111次组卷
|
2卷引用:四川省绵阳南山中学2023-2024学年高三上学期第二次综合演练理综化学试题
名校
解题方法
4 . 元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R分别代表一种元素。请依据这7种元素回答下列问题:

(1)以上7种元素中原子半径最大的元素是___________ 。(填元素符号)
(2)Q的原子结构示意图为___________ 。
(3)A和F能组成原子个数比为1:1的化合物,该化合物的电子式为___________ ;D和F能组成原子个数比为1:2的化合物,该化合物的结构式为___________ 。
(4)A、G、F三种元素组成的化合物中有哪些化学键___________ 。
(5)为了验证D和M二种元素非金属性的强弱,设计下图装置进行实验

请回答:
①仪器A的名称是___________ 。
②现有试剂:稀硫酸、碳酸钠溶液、碳酸钙、硫酸钠溶液、澄清石灰水。从所给试剂中选择合适的试剂,用如图装置证明D和M两种元素非金属性:M>D,A中装试剂___________ ,C中的实验现象___________ 。
(6)F、M的简单氢化物的沸点由高到低的顺序为___________ (用化学式表示),原因是___________ 。

(1)以上7种元素中原子半径最大的元素是
(2)Q的原子结构示意图为
(3)A和F能组成原子个数比为1:1的化合物,该化合物的电子式为
(4)A、G、F三种元素组成的化合物中有哪些化学键
(5)为了验证D和M二种元素非金属性的强弱,设计下图装置进行实验

请回答:
①仪器A的名称是
②现有试剂:稀硫酸、碳酸钠溶液、碳酸钙、硫酸钠溶液、澄清石灰水。从所给试剂中选择合适的试剂,用如图装置证明D和M两种元素非金属性:M>D,A中装试剂
(6)F、M的简单氢化物的沸点由高到低的顺序为
您最近一年使用:0次
名校
5 . X、Y、Z、W是短周期元素,原子序数递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应,也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。
(1)HWO的结构式为___________ 。
(2)①X、Y、Z、W原子半径由大到小依次是___________ (填元素符号)。
②X、Z、W最高价氧化物对应水化物的酸性由强到弱依次是___________ (填化学式)。
(3)①家用“管道通”的有效成分是烧碱和Y的单质,使用时需加入一定量的水,此时发生反应的化学方程式为___________ 。
②含Y元素的盐与小苏打溶液可用作泡沫灭火剂,写出灭火时发生反应的离子方程式:___________ 。
(4)NW3是黄色油状液体,无漂白性,在热水中会发生水解。NW3的电子式为___________ 。若取该液体滴入50℃左右的热水中,片刻后取该热溶液滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色。写出NW3在热水中发生水解的化学方程式:___________ 。
(1)HWO的结构式为
(2)①X、Y、Z、W原子半径由大到小依次是
②X、Z、W最高价氧化物对应水化物的酸性由强到弱依次是
(3)①家用“管道通”的有效成分是烧碱和Y的单质,使用时需加入一定量的水,此时发生反应的化学方程式为
②含Y元素的盐与小苏打溶液可用作泡沫灭火剂,写出灭火时发生反应的离子方程式:
(4)NW3是黄色油状液体,无漂白性,在热水中会发生水解。NW3的电子式为
您最近一年使用:0次
名校
6 . 元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列,得到如图所示的“蜗牛元素周期表”,图中每个圆圈代表一种元素,其中①代表氢元素。请回答下列问题:

(1)⑨在元素周期表中的位置为_______ 。
(2)④⑤⑦的离子半径由大到小的顺序为_______ 。
(3)③⑨⑩的最高价氧化物对应水化物的酸性由强到弱的顺序是_______ (填化学式)。
(4)用电子式表示由⑦和①组成的化合物的形成过程:_______ 。
(5)实验室制取④的简单氢化物的化学方程式为_______ 。
(6)可以验证⑦、⑧两元素金属性强弱的实验是_______(填字母)。

(1)⑨在元素周期表中的位置为
(2)④⑤⑦的离子半径由大到小的顺序为
(3)③⑨⑩的最高价氧化物对应水化物的酸性由强到弱的顺序是
(4)用电子式表示由⑦和①组成的化合物的形成过程:
(5)实验室制取④的简单氢化物的化学方程式为
(6)可以验证⑦、⑧两元素金属性强弱的实验是_______(填字母)。
| A.比较⑦、⑧两种元素的单质的硬度及熔点 |
| B.将除去氧化物薄膜的⑦、⑧的单质分别和热水作用,并滴入酚酞溶液 |
| C.将除去氧化物薄膜的⑦、⑧的单质分别和2mL1 mol∙L−1的盐酸反应 |
| D.比较⑦、⑧两种元素的最高价氧化物对应水化物的溶解性 |
您最近一年使用:0次
名校
解题方法
7 . W、X、Y、Z是原子序数依次增大的四种短周期元素。W的气态氢化物能使紫色石蕊溶液变蓝,W、X和Y三种元素的最高价氧化物对应的水化物两两之间可以发生反应,W、X、Y、Z的最外层电子数之和为16。回答下列问题(涉及元素均用化学符号表达):
(1)X与氧的化合物中呈淡黄色的物质,其阳离子与阴离子的个数比为___________ ,其电子式是___________ 。
(2)W、X、Y、Z的简单离子半径由大到小的顺序是:___________ 。
(3)以上四种元素最高价氧化物对应水化物中,酸性最强的酸化学式是___________ 。
(4)X最高价氧化物对应的水化物与Y单质反应的离子方程式为___________ 。
(5)Z和氧元素、硫元素组成的SOZ2,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出。请据此写出化合物SOZ2和水反应的化学方程式___________ 。
(1)X与氧的化合物中呈淡黄色的物质,其阳离子与阴离子的个数比为
(2)W、X、Y、Z的简单离子半径由大到小的顺序是:
(3)以上四种元素最高价氧化物对应水化物中,酸性最强的酸化学式是
(4)X最高价氧化物对应的水化物与Y单质反应的离子方程式为
(5)Z和氧元素、硫元素组成的SOZ2,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出。请据此写出化合物SOZ2和水反应的化学方程式
您最近一年使用:0次
名校
8 . A、X、Y、Z、R、W为六种短周期元素。A是短周期中半径最小的元素;X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常作耐高温材料。回答下列问题:
(1)Y元素的名称是___________ ,W在周期表中的位置是___________ 。
(2)写出化合物AZX的结构式:___________ ;化合物R2X2存在的化学键类型是___________ 。
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:___________ (用离子符号表示)。
(4)下列事实能证明非金属性Z比Y强的是___________ (填序号)。
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:___________ 。
(6)用电子式表示RZ的形成过程:___________ 。
(1)Y元素的名称是
(2)写出化合物AZX的结构式:
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:
(4)下列事实能证明非金属性Z比Y强的是
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:
(6)用电子式表示RZ的形成过程:
您最近一年使用:0次
2020-12-11更新
|
333次组卷
|
5卷引用:四川省江油中学2021届高三上学期开学考试理综化学试题
解题方法
9 . 已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
请回答下列问题:
(1)W元素位于周期表的第___ 周期___ 族,W2+能与X、Y形成的简单分子结合生成一种深蓝色的离子,其离子符号为___ 。
(2)X与Z按原子个数比为1:1组合得到的一种物质甲,它能用于杀菌消毒,物质甲的电子式为___ ;Q与T也能按原子个数比为1:1组合,得到一种暗黄色的液体乙,其结构与甲相似,则乙中存在的化学键类型有___ 和___ ;乙遇水发生歧化反应,得到一种淡黄色的固体和两种具有刺激性气味的气体,该反应的化学反应方程式为___ 。
(3)元素Q的简单离子半径___ 元素T的简单离子半径(填“>”“<”或“=”);元素T能形成多种含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由强到弱的顺序为___ (用化学式表示)。
| X | 宇宙中含量最丰富的元素 |
| Y | 植物生长所必需的三种营养元素中,电负性最大的 |
| Z | 原子最外层电子数是其电子层数的3倍 |
| Q | 其气态氢化物与其低价氧化物常温下能反应,生成该元素的单质 |
| T | 最高正价与最低负价代数和为6,其单质能与强碱溶液反应制消毒液 |
| W | 其+2价阳离子的价电子排布为3d9 |
(1)W元素位于周期表的第
(2)X与Z按原子个数比为1:1组合得到的一种物质甲,它能用于杀菌消毒,物质甲的电子式为
(3)元素Q的简单离子半径
您最近一年使用:0次
10 . 近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______ ,其沸点比NH3的_______ (填“高”或“低”),其判断理由是_________________________ 。
(2)Fe成为阳离子时首先失去______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________ 。
(3)比较离子半径:F−__________ O2−(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____________ ,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________ g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(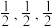 ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为__________ 、__________ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
(2)Fe成为阳离子时首先失去
(3)比较离子半径:F−
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
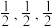 ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
您最近一年使用:0次
2019-06-09更新
|
14266次组卷
|
17卷引用:四川省泸州市泸县第二中学2020届高三上学期开学考试理综化学试题
四川省泸州市泸县第二中学2020届高三上学期开学考试理综化学试题四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题2019年全国统一考试化学试题(新课标Ⅱ)2020年闽粤赣三省十二校高三联合调研考试理综化学试题西藏自治区林芝市第二高级中学2020届高三上学期第一次月考理科综合化学试题(已下线)专题6.4 物质结构与性质(选考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升安徽省六安市城南中学2021届高三上学期第一次月考化学试题(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题20 结构与性质(已下线)T35-物质结构与性质甘肃省兰州市第一中学2019-2020学年高二下学期4月月考化学试题



