名校
1 . A、B、C、D、E五种原子序数均小于18的元素,且原子序数依次增大,其中B与C的电子层数相同,D与E的电子层数相同,A与D的最外层电子数相同,C与E的最外层电子数相同,E元素的原子最外层电子数是电子层数的2倍,D与其他具有相同电子层数的原子相比半径最大。又知由B元素组成的单质是空气中的主要成分。
(1)B的元素名称是_______ ,该元素的原子结构示意图为_______ ,核外有___ 个未成对电子,用电子式表示B的简单氢化物的形成过程_________ 。
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是________ (用离子符号表示)。
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)_____ 。
(4)以下说法正确的是________ 。
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
(1)B的元素名称是
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)
(4)以下说法正确的是
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
您最近一年使用:0次
2024-01-21更新
|
133次组卷
|
2卷引用:黑龙江省牡丹江市第三高级中学2023-2024学年高三上学期第三次月考化学试卷
解题方法
2 . A、B、C、D、E、F、G均为常见短周期元素,原子序数依次递增。已知A、B、C能分别与D组成二元化合物K、L、M,甲、乙分别是B、D的单质,常温下分别是常见的固体和气体,化合物M是产生光化学烟雾的主要气体之一,丙是C的最高价氧化物对应的水化物,它们之间有如图所示转化关系。E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
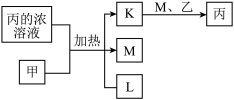
(1)C在元素周期表中的位置为_______ 。
(2)甲与丙的浓溶液反应的化学方程式为_______ 。
(3)化合物L的电子式为_______ ,M与水发生反应的化学方程式是_______ ,该反应的还原产物是_______ 。
(4)E、F、G形成的简单离子,半径由大到小顺序是_______ (用离子符号表示)。B、F、G元素的非金属性由强到弱的顺序_______ (用元素符号表示)。

(1)C在元素周期表中的位置为
(2)甲与丙的浓溶液反应的化学方程式为
(3)化合物L的电子式为
(4)E、F、G形成的简单离子,半径由大到小顺序是
您最近一年使用:0次
名校
解题方法
3 . 物质之间的转化关系如图,部分生成物省略。A是由四种元素组成的化合物。C、D是由元素X、Y、Z中两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用。
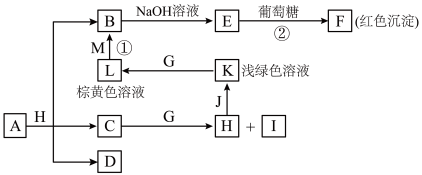
请回答下列问题:
(1)C的电子式____ 。
(2)写出反应①的离子反应方程式____ ,反应②中体现葡萄糖的____ 性。
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。____
(4)写出A的化学式____ 。
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式____ 。
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式____ ,N的一种同素异形体的名称为____ 。

请回答下列问题:
(1)C的电子式
(2)写出反应①的离子反应方程式
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。
(4)写出A的化学式
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式
您最近一年使用:0次
2022-09-20更新
|
344次组卷
|
5卷引用:黑龙江省哈尔滨市第三中学校2022-2023学年高三上学期第一次验收考试化学试题
名校
解题方法
4 . 卤族元素的单质及化合物性质丰富,在科研和生产中有许多重要用途。请回答:
(1)卤族元素位于元素周期表的___________ 区,其中电负性最大的是___________ (填元素符号),溴原子的M能层电子排布式为___________ 。
(2)基态氯原子核外有___________ 种运动状态不同的电子,其中单电子占据的轨道形状为___________ 。
(3)下列物质性质递变规律正确的是___________。
(4)碘在水中的溶解度小,在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2
 。
。 离子的空间构型为
离子的空间构型为___________ 。
(5)SiCl4发生水解的机理如图:
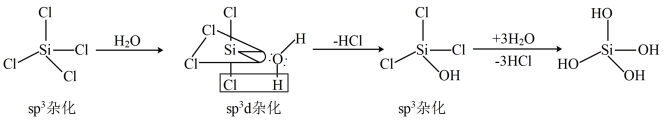
CCl4不能按照上述机理发生水解反应,原因是___________ 。
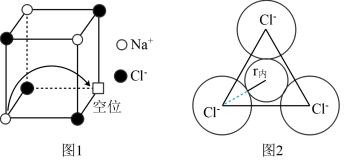
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确____________ 。(已知: ≈1.414,
≈1.414, ≈1.732)
≈1.732)
(1)卤族元素位于元素周期表的
(2)基态氯原子核外有
(3)下列物质性质递变规律正确的是___________。
| A.原子半径: F<C1<Br<I |
| B.第一电离能: F<Cl<Br<I |
| C.沸点:HCl<HBr<HI<HF |
| D.熔点: CaF2<CaCl2<CaBr2<CaI2 |

 。
。 离子的空间构型为
离子的空间构型为(5)SiCl4发生水解的机理如图:

CCl4不能按照上述机理发生水解反应,原因是
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确
 ≈1.414,
≈1.414, ≈1.732)
≈1.732)
您最近一年使用:0次
5 . W、X、Y、Z、R是原子序数依次递增的五种短周期元素,Y原子核外电子数与W、X的最外层电子数之和相等,Y原子半径是短周期元素原子半径中最大的,R最高正价与最低负价代数和为4,W的一种氢化物常作制冷剂,Z原子的电子层数与最外层电子数相等。回答下列问题:
(1)W元素的名称为___________ ,R元素在周期表中位于第三周期___________ 族。
(2)X、Z、R所形成的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(3)R的简单氢化物的电子式为___________ ;W、X的最简单氢化物稳定性关系:___________ (填氢化物化学式)。
(4)Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(5) 与
与 气体发生氧化还原反应,生成X的常见单质和一种盐,写出该反应的化学方程式:
气体发生氧化还原反应,生成X的常见单质和一种盐,写出该反应的化学方程式:___________ 。
(1)W元素的名称为
(2)X、Z、R所形成的简单离子半径由大到小的顺序为
(3)R的简单氢化物的电子式为
(4)Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式为
(5)
 与
与 气体发生氧化还原反应,生成X的常见单质和一种盐,写出该反应的化学方程式:
气体发生氧化还原反应,生成X的常见单质和一种盐,写出该反应的化学方程式:
您最近一年使用:0次
6 . 现有A、B、C、D、E、F、G七种短周期主族元素,原子序数依次增大。A与C形成的化合物能使湿润的红色石蕊试纸变蓝;D是地壳中含量最多的元素;D、F原子的最外层电子数相等;E的焰色反应呈黄色;B元素的一种同位素在考古时可用于测定一些文物的年代。请回答下列问题:(注意回答问题时均用元素符号表示)
(1)元素B在周期表中的位置:___________ 。
(2)元素A与C组成的10电子的阳离子的电子式:___________ 。元素A与D组成的18电子分子的结构式:___________ 。
(3) 和
和 形成的一种化合物与A2D发生氧化还原反应,写出该反应的化学方程式并用双线桥标出电子转移的方向与数目:
形成的一种化合物与A2D发生氧化还原反应,写出该反应的化学方程式并用双线桥标出电子转移的方向与数目:___________ 。
(4)D和F的简单气态氢化物沸点比较高的是:___________ (写分子式),原因:______ 。
(5) 、
、 、
、 、G的简单离子半径由小到大的顺序为
、G的简单离子半径由小到大的顺序为___________ (用离子符号表示)。
(6)用电子式表示化合物E2D的形成过程:___________ 。
(1)元素B在周期表中的位置:
(2)元素A与C组成的10电子的阳离子的电子式:
(3)
 和
和 形成的一种化合物与A2D发生氧化还原反应,写出该反应的化学方程式并用双线桥标出电子转移的方向与数目:
形成的一种化合物与A2D发生氧化还原反应,写出该反应的化学方程式并用双线桥标出电子转移的方向与数目:(4)D和F的简单气态氢化物沸点比较高的是:
(5)
 、
、 、
、 、G的简单离子半径由小到大的顺序为
、G的简单离子半径由小到大的顺序为(6)用电子式表示化合物E2D的形成过程:
您最近一年使用:0次
解题方法
7 . .短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)E2D2的电子式:___ 。
(2)B与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为___ ,Q与水反应的化学方程式为___ 。
(3)A,C,D,E的原子半径由大到小的顺序是___ (用元素符号表示)。
(4)元素B和F的非金属性强弱,B的非金属性___ 于F(填“强”或“弱”),并用化学方程式证明上述结论___ 。
(1)E2D2的电子式:
(2)B与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为
(3)A,C,D,E的原子半径由大到小的顺序是
(4)元素B和F的非金属性强弱,B的非金属性
您最近一年使用:0次
名校
8 . 如表列出了①~⑦七种元素在周期表中的位置。请按要求回答:
(1)七种元素中,原子半径最大的是(填元素符号)___________ 。
(2)③与⑦的简单氢化物中,稳定性较强的是(填化学式)___________ ,该物质的分子为___________ (填“极性”或“非极性”)分子。
(3)元素②形成的一种氢化物常用作火箭燃料,则该物质的电子式为___________ 。
(4)元素④的最高价氧化物对应的水化物与元素⑤的最高价氧化物对应的水化物发生反应的离子方程式为___________ 。
(5)由①、②、③三种元素组成的离子化合物是___________ ,检验该化合物中阳离子的方法是___________ 。
(6)下列事实能说明O的非金属性比S的非金属性强的是___________(填字母代号)。
(7)含有上述元素的物质间存在如图转化。
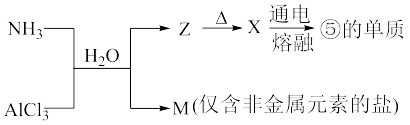
M所含的化学键类型是___________ ,实验室检验AlCl3是否为离子化合物的方法___________ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)七种元素中,原子半径最大的是(填元素符号)
(2)③与⑦的简单氢化物中,稳定性较强的是(填化学式)
(3)元素②形成的一种氢化物常用作火箭燃料,则该物质的电子式为
(4)元素④的最高价氧化物对应的水化物与元素⑤的最高价氧化物对应的水化物发生反应的离子方程式为
(5)由①、②、③三种元素组成的离子化合物是
(6)下列事实能说明O的非金属性比S的非金属性强的是___________(填字母代号)。
| A.O2与H2S溶液反应,溶液变浑浊 |
| B.加热条件下H2S比H2O更容易分解 |
| C.在氧化还原反应中,1 mol O2比1 mol S得电子多 |
| D.H2O的沸点比H2S高 |
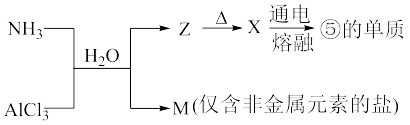
M所含的化学键类型是
您最近一年使用:0次
名校
9 . A、X、Y、Z、R、W为六种短周期元素。A是短周期中半径最小的元素;X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常作耐高温材料。回答下列问题:
(1)Y元素的名称是___________ ,W在周期表中的位置是___________ 。
(2)写出化合物AZX的结构式:___________ ;化合物R2X2存在的化学键类型是___________ 。
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:___________ (用离子符号表示)。
(4)下列事实能证明非金属性Z比Y强的是___________ (填序号)。
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:___________ 。
(6)用电子式表示RZ的形成过程:___________ 。
(1)Y元素的名称是
(2)写出化合物AZX的结构式:
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:
(4)下列事实能证明非金属性Z比Y强的是
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:
(6)用电子式表示RZ的形成过程:
您最近一年使用:0次
2020-12-11更新
|
333次组卷
|
5卷引用:黑龙江省大庆市铁人中学2021届高三上学期期中考试化学试题
10 . A、B、C、D、E、F、G、L、I九种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中B、C、D位于同一周期,A与E、B与G、D与L分别位于同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)元素B在周期表中的位置_________________ ,以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)________ ,D、E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)___________ 。
(2)L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为________ 。
(3)CI3常温下呈液态,可与水反应生成一种酸和一种碱,反应的化学方程式为_____________________ 。
(4)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:___________ 。
(1)元素B在周期表中的位置
(2)L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为
(3)CI3常温下呈液态,可与水反应生成一种酸和一种碱,反应的化学方程式为
(4)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:
您最近一年使用:0次



