名校
1 . 硫酸亚铁铵[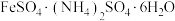 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为___________ 。
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为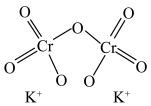 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。
(3)圆底烧瓶中生成 的离子方程式为
的离子方程式为___________ 。
(4)第二步中需要称量剩余铁屑质量的原因为___________ ,写出制备硫酸亚铁铵晶体的化学方程式:___________ 。
(5)试剂N是___________ 。
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。
①重铬酸钾在酸性条件下的还原产物为 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:___________ 。
②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为___________ (写出含M的表达式)。
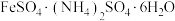 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL
 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。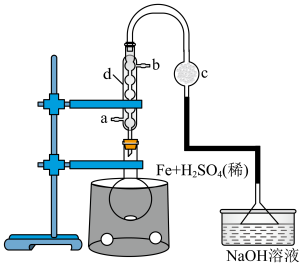
 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为
 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。A. | B. | C.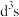 | D.sp |
(3)圆底烧瓶中生成
 的离子方程式为
的离子方程式为(4)第二步中需要称量剩余铁屑质量的原因为
(5)试剂N是
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL
 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。①重铬酸钾在酸性条件下的还原产物为
 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为
您最近一年使用:0次
2024-05-26更新
|
112次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
2 . 下表是元素周期表的部分,表中所列的数字分别代表某一种元素。针对表中①-⑩号元素回答下列问题。
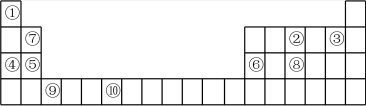
(1)⑩元素的名称是___________ ,⑨元素的原子结构示意图为___________ 。
(2)②、③、④、⑤、⑥五种元素中,原子半径由小到大的顺序是___________ (填元素符号);这五种元素分别形成的简单离子中离子半径最小的是___________ 。(填离子符号)
(3)某些不同族元素的性质也有一定的相似性,如表中元素⑦与元素⑥的氢氧化物有相似的性质,请写出元素⑦的氢氧化物与NaOH溶液反应的化学方程式:___________ 。
(4)元素①和④的单质化合形成的化合物能与水反应生成氢气,向反应后的溶液中滴入酚酞,溶液变红,反应的化学方程式为_________ 。
(5)元素④和⑥相比,金属性较强的是_________ (填元素符号),下列能证明这一事实的有_________ (填序号)。
A.在化合物中④的化合价比⑥的低 B.④的单质能与冷水剧烈反应而⑥的单质不能
C.④的最高价氧化物对应水化物的碱性比⑥强 D.④单质的熔点比⑥单质的低
(6)⑧号元素有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产的还原剂。
I.已知H3PO2是一种一元弱酸,向Ba(H2PO2)2溶液中加入H2SO4制备H3PO2,写出该反应的离子方程式___________ 。
Ⅱ.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是___________ (选填编号)。
a.升高 b.降低 c.既升高又降低

(1)⑩元素的名称是
(2)②、③、④、⑤、⑥五种元素中,原子半径由小到大的顺序是
(3)某些不同族元素的性质也有一定的相似性,如表中元素⑦与元素⑥的氢氧化物有相似的性质,请写出元素⑦的氢氧化物与NaOH溶液反应的化学方程式:
(4)元素①和④的单质化合形成的化合物能与水反应生成氢气,向反应后的溶液中滴入酚酞,溶液变红,反应的化学方程式为
(5)元素④和⑥相比,金属性较强的是
A.在化合物中④的化合价比⑥的低 B.④的单质能与冷水剧烈反应而⑥的单质不能
C.④的最高价氧化物对应水化物的碱性比⑥强 D.④单质的熔点比⑥单质的低
(6)⑧号元素有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产的还原剂。
I.已知H3PO2是一种一元弱酸,向Ba(H2PO2)2溶液中加入H2SO4制备H3PO2,写出该反应的离子方程式
Ⅱ.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是
a.升高 b.降低 c.既升高又降低
您最近一年使用:0次
解题方法
3 . 下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题

(1)表中某元素最高正价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是______ ,由元素④、⑥、⑦、⑧形成的简单离子的半径由大到小的顺序是_______ (用离子符号表示,下同)。②、④、⑤元素的氢化物的沸点由高到低的顺序是____________ 。
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是________________ 。
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:

①X、Y与水混合后反应的离子方程式为________________ 。
②N→⑦的单质反应的化学方程式为_________________ 。
③若将Y溶液加热蒸干、灼烧后得到的物质的化学式是________________ 。

(1)表中某元素最高正价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:

①X、Y与水混合后反应的离子方程式为
②N→⑦的单质反应的化学方程式为
③若将Y溶液加热蒸干、灼烧后得到的物质的化学式是
您最近一年使用:0次
2019-01-30更新
|
528次组卷
|
2卷引用:2016届重庆市南开中学高三7月月考化学试卷1
解题方法
4 . A、B、D、R、Q五种短周期主族元素,其原子序数依次增大,其中A原子核内无中子,B与D同周期,R与Q同周期,A与R同主族,D与Q同主族,D元素的原子最外层电子数是次外层电子数的三倍,B元素的最高正价和最低负价代数和为2。请用对应的化学用语回答下列问题:
(1)Q元素位于元素周期表中第______ 周期_____ 族。
(2)D、R、Q三种元素形成的简单离子的半径由大到小的顺序是________ (用离子符号表示)。
(3)由A、B两种元素以原子个数比为5:1形成的离子化合物X,X的电子式为_______ 。
(4)由A、B元素形成的A2B4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为____ 。
(5)由A、D、R、Q四种元素形成的化合物Y(RAQD3)(已知A2QD3的Ka1=1.2×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为_______________ ;室温下,向Y溶液中加入一定量的NaOH,使溶液中c(AQD3-)=c(QD32-),则此时溶液呈______ (填“酸性”、“碱性”或“中性”)
(6)Fe与D元素可形成Fe2D3、Fe3D4等化合物。向5.2g Fe2D3、Fe3D4、Cu的混合物中加入0.5mol/L的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为______ g。
(1)Q元素位于元素周期表中第
(2)D、R、Q三种元素形成的简单离子的半径由大到小的顺序是
(3)由A、B两种元素以原子个数比为5:1形成的离子化合物X,X的电子式为
(4)由A、B元素形成的A2B4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为
(5)由A、D、R、Q四种元素形成的化合物Y(RAQD3)(已知A2QD3的Ka1=1.2×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为
(6)Fe与D元素可形成Fe2D3、Fe3D4等化合物。向5.2g Fe2D3、Fe3D4、Cu的混合物中加入0.5mol/L的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
您最近一年使用:0次
10-11高三·重庆·阶段练习
解题方法
5 . 下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,
回答下列问题:
(1)⑩的离子结构示意图为______________ 。
(2)⑤⑥⑨⑩的离子半径由大到小的顺序为______________ (用离子符号表示)。
(3)④的氢化物沸点比⑨高,说明理由____________________________ 。
(4)上述元素构成的两个不同的10电子微粒,能反应生成两个相同的10电子微粒。写出二者反应的方程式为_________________________ 。
(5)由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,立即产生红褐色沉淀,但无气体产生,该化合物的电子式_____ ,该反应的离子方程式______________ 。
回答下列问题:
 族周期 族周期 | IA | 0 | ||||||
| 1 | ① | Ⅱ | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑩的离子结构示意图为
(2)⑤⑥⑨⑩的离子半径由大到小的顺序为
(3)④的氢化物沸点比⑨高,说明理由
(4)上述元素构成的两个不同的10电子微粒,能反应生成两个相同的10电子微粒。写出二者反应的方程式为
(5)由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,立即产生红褐色沉淀,但无气体产生,该化合物的电子式
您最近一年使用:0次



