1 . Ⅰ.中国学者姜雪峰、雷晓光入选国际纯粹与应用化学联合会(IUPAC)发起的“化学家元素周期表”的征集提名,分别成为“S”、“N”元素的代言人。硒与硫最外层电子数相同,已知硒的原子结构示意图如图所示 ,试回答下列问题:
,试回答下列问题:
(1)硒在元素周期表中的位置为___________ 。
(2)结合元素周期律,比较并解释硒与硫元素的非金属性强弱:___________ 。
(3)下列说法正确的是___________ (填字母字号)。
a.热稳定性: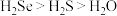 b.
b.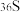 与
与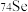 的中子数之和为60
的中子数之和为60
c.酸性: d.还原性:
d.还原性: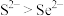
(4)试比较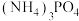 中各元素的原子半径大小
中各元素的原子半径大小___________ (用元素符号由大到小表示)。
Ⅱ.以金红石(主要成分为 )为原料,,制取Ti的工艺流程如图所示:
)为原料,,制取Ti的工艺流程如图所示:

(5)①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为___________ 。
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为___________ ℃。

③Ⅱ中氩气的作用是___________ 。
④海绵钛除杂时得到的 可以循环使用,在上述工艺流程中可循环使用的物质还有
可以循环使用,在上述工艺流程中可循环使用的物质还有___________ (填化学式)。
 ,试回答下列问题:
,试回答下列问题:(1)硒在元素周期表中的位置为
(2)结合元素周期律,比较并解释硒与硫元素的非金属性强弱:
(3)下列说法正确的是
a.热稳定性:
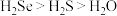 b.
b. 与
与 的中子数之和为60
的中子数之和为60c.酸性:
 d.还原性:
d.还原性: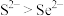
(4)试比较
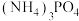 中各元素的原子半径大小
中各元素的原子半径大小Ⅱ.以金红石(主要成分为
 )为原料,,制取Ti的工艺流程如图所示:
)为原料,,制取Ti的工艺流程如图所示:
(5)①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

③Ⅱ中氩气的作用是
④海绵钛除杂时得到的
 可以循环使用,在上述工艺流程中可循环使用的物质还有
可以循环使用,在上述工艺流程中可循环使用的物质还有
您最近一年使用:0次
名校
2 . 某种化合物是工业洗涤剂的中间体,其结构如图所示。其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。回答下列问题:

(1)写出Q元素在周期表中的位置:
________ ,Z单质的电子式:
________ 。
(2)Y、Z、Q三种元素所形成的最简单气态氢化物中,稳定性最强的是
________ (填化学式);X、Y、Z、Q四种元素组成的化合物中,既含离子键又含共价键的是
________ (填化学式)。
(3)利用如图装置可比较Y、Z两元素得电子能力,b中发生反应的化学方程式为
________ 。

(4)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与Q同主族,则下列关于碲及其化合物的说法正确的是
________ (填字母)。

(1)写出Q元素在周期表中的位置:
(2)Y、Z、Q三种元素所形成的最简单气态氢化物中,稳定性最强的是
(3)利用如图装置可比较Y、Z两元素得电子能力,b中发生反应的化学方程式为

(4)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与Q同主族,则下列关于碲及其化合物的说法正确的是
| A.单质碲在常温下是固体 |
| B.H2Te比H2O稳定 |
| C.H2TeO4的酸性比HIO4弱 |
| D.Cl2通入H2Te溶液中不发生反应 |
您最近一年使用:0次
3 . X、Y,Z、W、M是原子序数依次增大的前四周期主族元素,已知X元素是农作物三大营养元素之一,Y、Z简单离子的核外电子运动状态数量相同,且二者之间能形成两种常见离子化合物;基态W、M原子中能量最高的电子位于N能层上,且二者可形成 的化合物,该化合物在气态时以
的化合物,该化合物在气态时以 的形式存在。
的形式存在。
(1)X、Y、Z简单离子的半径由大到小的顺序为___________ (用离子符号表示),Y、Z两元素形成的含有 键的化合物的电子式为
键的化合物的电子式为___________ 。
(2)已知W的单质既能与强酸反应,又能与强碱反应,写出其单质与NaOH溶液反应的离子方程式:___________ ; 中存在配位键,写出其结构式并用“→”标出配位键:
中存在配位键,写出其结构式并用“→”标出配位键:___________ 。
(3)X的一种氢化物 因能结合水电离出的
因能结合水电离出的 而表现出碱性,常温下,其电离常数分别为
而表现出碱性,常温下,其电离常数分别为 ,
, ,则
,则 发生一级电离的方程式为
发生一级电离的方程式为___________ ,当 4溶液中
4溶液中 时,该溶液的
时,该溶液的
___________ 。
 的化合物,该化合物在气态时以
的化合物,该化合物在气态时以 的形式存在。
的形式存在。(1)X、Y、Z简单离子的半径由大到小的顺序为
 键的化合物的电子式为
键的化合物的电子式为(2)已知W的单质既能与强酸反应,又能与强碱反应,写出其单质与NaOH溶液反应的离子方程式:
 中存在配位键,写出其结构式并用“→”标出配位键:
中存在配位键,写出其结构式并用“→”标出配位键:(3)X的一种氢化物
 因能结合水电离出的
因能结合水电离出的 而表现出碱性,常温下,其电离常数分别为
而表现出碱性,常温下,其电离常数分别为 ,
, ,则
,则 发生一级电离的方程式为
发生一级电离的方程式为 4溶液中
4溶液中 时,该溶液的
时,该溶液的
您最近一年使用:0次
名校
解题方法
4 . X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)Y在元素周期表中的位置为________ 。
(2)Z、Q、R的简单离子半径由小到大的顺序为________ (用化学用语表示,下同);写出Q、R最高价氧化物的水化物相互反应的化学方程式:________ ;Q、R简单离子中氧化性比较小的是_______ 。
(3)上述五种元素的某些元素可形成既含离子键又含非极性共价键的化合物,写出其中一种化合物的电子式________ 。
(4)Z、X两元素按原子数目比1:1和1:2构成分子A和B,A的结构式为_______ 。
(5)QX的电子式为_______ 。
(6)下列事实能说明Z元素的非金属性比S元素的非金属性强的是_______ (填序号)。
a.Z单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molZ单质比1molS得电子多
c.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(7)制备单质R时,电解熔点很高的R的氧化物而不电解熔点相对低的R的氯化物的原因是_______ 。
(1)Y在元素周期表中的位置为
(2)Z、Q、R的简单离子半径由小到大的顺序为
(3)上述五种元素的某些元素可形成既含离子键又含非极性共价键的化合物,写出其中一种化合物的电子式
(4)Z、X两元素按原子数目比1:1和1:2构成分子A和B,A的结构式为
(5)QX的电子式为
(6)下列事实能说明Z元素的非金属性比S元素的非金属性强的是
a.Z单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molZ单质比1molS得电子多
c.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(7)制备单质R时,电解熔点很高的R的氧化物而不电解熔点相对低的R的氯化物的原因是
您最近一年使用:0次
2023-08-28更新
|
70次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高三上学期8月月考化学试题
解题方法
5 . Li3OX(图a)和Li2OHX(图b)的晶胞结构,如图所示。
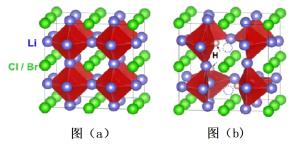
请回答下列问题:
(1)基态氯原子的价层电子排布式为_____ 。基态溴原子核外电子有_____ 种不同的空间运动状态。
(2)离子半径,r(Li+)=76pm,r(H-)=208pm,H-半径大于Li+的原因是_____ 。
(3)下列含锂的粒子中,失去1个电子需要的能量最低的是_____。
(4)已知几种元素的电负性数据如下:
①PBr3分子的空间结构是_____ 。在H2O、HCl、HBr、PH3中,共价键极性最弱的是_____ (填化学式)。。
②已知PCl5分子中P原子的s、p、d轨道参与杂化。试解释存在PCl5,不存在NCl5的主要原因可能是_____ 。
③在LiH、Li2O、LiCl、LiBr中,离子键百分率最高的是_____ (填化学式)。
(5)1个图b(Li2OHCl)晶胞的质量为_____ g(只列计算式)。
(6)如图a,晶胞参数为Apm,NA为阿伏加德罗常数的值。Li3OBr晶体密度为_____ g·cm-3(只列计算式)。

请回答下列问题:
(1)基态氯原子的价层电子排布式为
(2)离子半径,r(Li+)=76pm,r(H-)=208pm,H-半径大于Li+的原因是
(3)下列含锂的粒子中,失去1个电子需要的能量最低的是_____。
| A.1s22s1 | B.1s2 | C.1s12s1 | D.1s23s1 |
| 元素 | O | H | Cl | Br | P |
| 电负性 | 3.5 | 2.1 | 3.0 | 2.8 | 2.1 |
②已知PCl5分子中P原子的s、p、d轨道参与杂化。试解释存在PCl5,不存在NCl5的主要原因可能是
③在LiH、Li2O、LiCl、LiBr中,离子键百分率最高的是
(5)1个图b(Li2OHCl)晶胞的质量为
(6)如图a,晶胞参数为Apm,NA为阿伏加德罗常数的值。Li3OBr晶体密度为
您最近一年使用:0次
解题方法
6 . 一种新型硫酸盐功能电解液由2mol·L-1Na2SO4和0.3mol·L-1MgSO4混合组成,电化学测试表明该电解液构建的Na2Ni[Fe(CN)6]、NaTi2(PO4)3/C电池可以稳定循环500次以上。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是___________ (用元素符号表示),其中电负性最大的元素是___________ (填名称)。
(2)第一电离能N>O的原因是___________ 。
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有___________ 种,[Fe(CN)6]4-中σ键和π键的数目之比为___________ 。
(4)NaTi2(PO4)3中, 中磷原子的杂化类型是
中磷原子的杂化类型是___________ 。
(5)N、O两种元素形成的简单氢化物的熔点:NH3___________ H2O(填“>”“<”或“=”),其原因是___________ 。
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=___________ 。
②该晶体密度是___________ g·cm-3(用含n、NA的代数式表示)。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是
(2)第一电离能N>O的原因是
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有
(4)NaTi2(PO4)3中,
 中磷原子的杂化类型是
中磷原子的杂化类型是(5)N、O两种元素形成的简单氢化物的熔点:NH3
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=
②该晶体密度是
您最近一年使用:0次
2023-04-26更新
|
279次组卷
|
3卷引用:河南省名校大联考2023届高三下学期三模考试理综化学试题
河南省名校大联考2023届高三下学期三模考试理综化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题
7 . 硬铝(主要成分为Al、Cu、Mg、M、Si)主要用于生产各种构件和铆钉,在造船和建筑等行业也有广泛的应用。回答下列问题。
(1)处于基态的Al原子和Mg原子,下列参数中Al原子较大的是______ (填标号)。
A.未成对电子数 B.第一电离能 C.原子半径
(2)硅元素很难形成含多重键的化合物,最近我国科学家在合成的二硅炔镁盐中探测到有“Si=Si”键的存在。硅元素难以形成“Si=Si”键的原因是______ 。
(3)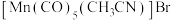 是一种重要的配合物,
是一种重要的配合物,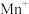 的配位数为
的配位数为______ , 提供孤电子对的原子为
提供孤电子对的原子为______ ,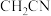 分子中碳原子的杂化类型为
分子中碳原子的杂化类型为______ , 中三种元素的电负性由大到小的顺序为
中三种元素的电负性由大到小的顺序为______ 。
(4)氧化镁晶胞属于立方形晶胞,其晶胞参数为anm。晶胞中每个 周围紧邻且距离相等的
周围紧邻且距离相等的 共有
共有______ 个,其最近距离为______ nm。设阿伏加德罗常数的值为 ,则氧化镁晶体的密度为
,则氧化镁晶体的密度为______  (列出计算表达式)。
(列出计算表达式)。

(1)处于基态的Al原子和Mg原子,下列参数中Al原子较大的是
A.未成对电子数 B.第一电离能 C.原子半径
(2)硅元素很难形成含多重键的化合物,最近我国科学家在合成的二硅炔镁盐中探测到有“Si=Si”键的存在。硅元素难以形成“Si=Si”键的原因是
(3)
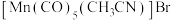 是一种重要的配合物,
是一种重要的配合物,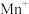 的配位数为
的配位数为 提供孤电子对的原子为
提供孤电子对的原子为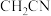 分子中碳原子的杂化类型为
分子中碳原子的杂化类型为 中三种元素的电负性由大到小的顺序为
中三种元素的电负性由大到小的顺序为(4)氧化镁晶胞属于立方形晶胞,其晶胞参数为anm。晶胞中每个
 周围紧邻且距离相等的
周围紧邻且距离相等的 共有
共有 ,则氧化镁晶体的密度为
,则氧化镁晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
名校
解题方法
8 . 已知A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。回答下列问题:
(1)B、C、G的简单氢化物中稳定性最弱的是____ (填化学式)。
(2)G的某种氧化物能使酸性KMnO4溶液褪色,反应的离子方程式为____ 。
(3)B、C、D、E、F形成的简单离子半径由小到大的顺序为____ (用离子符号表示)。
(4)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为____ ,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是____ 。
(5)F的最高价氧化物对应的水化物和D的最高价氧化物对应的水化物的水溶液发生反应的离子方程式为____ 。
(1)B、C、G的简单氢化物中稳定性最弱的是
(2)G的某种氧化物能使酸性KMnO4溶液褪色,反应的离子方程式为
(3)B、C、D、E、F形成的简单离子半径由小到大的顺序为
(4)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为
(5)F的最高价氧化物对应的水化物和D的最高价氧化物对应的水化物的水溶液发生反应的离子方程式为
您最近一年使用:0次
2022-10-30更新
|
273次组卷
|
2卷引用:河南省名校2022-2023学年高三上学期10月联考化学试题
名校
解题方法
9 . 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原子的质子数是其M层电子数的三倍。回答下列问题:
(1)Y元素在元素周期表中的位置为_______ 。X、Y、W三种元素原子半径由大到小的顺序为_______ (用元素符号表示)。
(2)X、Q可形成一种化合物,该化合物中两元素最外层均满足8电子稳定结构,写出该化合物的电子式:_______ 。
(3)X、W、Q的最高价氧化物对应水化物的酸性由强到弱的顺序为_______ (用化学式表示)。
(4)写出工业制取Z的化学方程式:_______ 。
(5)W、Q形成的一种化合物可以发生水解反应,并且水解生成一种最高价含氧酸和一种无氧酸,写出该水解反应的化学方程式:_______ 。
| X | Y | |||
| Z | W | Q |
(2)X、Q可形成一种化合物,该化合物中两元素最外层均满足8电子稳定结构,写出该化合物的电子式:
(3)X、W、Q的最高价氧化物对应水化物的酸性由强到弱的顺序为
(4)写出工业制取Z的化学方程式:
(5)W、Q形成的一种化合物可以发生水解反应,并且水解生成一种最高价含氧酸和一种无氧酸,写出该水解反应的化学方程式:
您最近一年使用:0次
2022-10-28更新
|
97次组卷
|
2卷引用:河南省安阳市2022-2023学年高三上学期第一次联考(二)全国卷化学试题
名校
10 . 元素周期律、表是我们研究、预测物质性质的重要工具。
I.几种短周期元素的原子半径及主要化合价如下表:
(1)写出元素①、③形成的含有10个电子的微粒的电子式_______ (写出一种即可)。
(2)元素②在周期表中的位置是_______ 。
(3)元素④的单质与元素⑤的单质在加热条件下反应生成的化合物中含有的化学键类型为____ 。
(4)元素④⑤⑦的简单离子半径由大到小的顺序为_______ 。
(5)依据所学知识,任意写出2条能体现元素非金属性⑥<⑦的事实_______ 。
II.对硅及其化合物的性质进行研究。
(6)依据上表,可预测Si原子半径大小范围是_______ 。
(7)Si的最高价氧化物与NaOH溶液反应的产物有Y和H2O,请写出Y与稀硫酸反应的化学方程式_______ 。
I.几种短周期元素的原子半径及主要化合价如下表:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑥ | |
原子半径/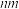 | 0.030 | 0.077 | 0.070 | 0.066 | 0.186 | 0.110 | 0.106 |
| 最外层电子数 | 1 | 4 | 1 | 5 | |||
| 常见化合价 |  、 、 |  |  、 、 |
(2)元素②在周期表中的位置是
(3)元素④的单质与元素⑤的单质在加热条件下反应生成的化合物中含有的化学键类型为
(4)元素④⑤⑦的简单离子半径由大到小的顺序为
(5)依据所学知识,任意写出2条能体现元素非金属性⑥<⑦的事实
II.对硅及其化合物的性质进行研究。
(6)依据上表,可预测Si原子半径大小范围是
(7)Si的最高价氧化物与NaOH溶液反应的产物有Y和H2O,请写出Y与稀硫酸反应的化学方程式
您最近一年使用:0次
2022-09-06更新
|
89次组卷
|
2卷引用:河南省宋基信阳实验中学2022-2023学年高三上学期11月月考化学试题



